1、选择题 导致下列现象的主要原因与排放NO无关的是
A.酸雨
B.光化学烟雾
C.臭氧空洞
D.温室效应
2、实验题 (16分)氨是一种重要的化工原料,某学习小组欲制取氨气并探究其性质。请回答:
(1)实验室制取氨气的化学方程式是?。
(2)①右图是进行氨气喷泉实验的装置,引发喷泉的操作步骤是?。

②氨气使烧杯中溶液由无色变为红色,其原因是_______________________________(用电离方程式表示)。
(3)该小组同学设计了下图所示的实验装置(部分夹持仪器未画出),探究氨气的还原性并检验产物。
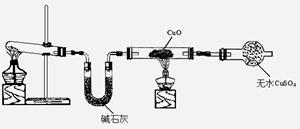
①实验现象为:黑色CuO变为红色;白色无水CuSO4粉末变为蓝色;同时生成一种无色气体,该气体无污染。请写出氨气与CuO反应的化学方程式?。
②碱石灰的作用是?。
③该装置存在明显缺陷,请指出存在的问题并提出改进意见?
?。
(4)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。已知:Cu2O是一种碱性氧化物;在酸性溶液中,Cu+的稳定性比Cu2+差(Cu+ Cu + Cu2+)。
Cu + Cu2+)。
请你设计一个简单的实验检验该红色物质中是否含有Cu2O。?
?;
(5)工业废气中的氮氧化物是主要的大气污染物之一。为了治理污染,工业上常用氨气与之发生反应:NOx+NH3→N2+H2O,使其转化为无毒的N2 。现有NO2和NO的混合气体3.0 L,跟3.4 L(同温同压下)NH3反应,恰好使其全部转化为氮气,则原混合气体中,NO2与NO的体积比是__________。
3、实验题 某化学课外活动小组通过实验研究NO2的性质。
已知:2NO2+2NaOH NaNO3+NaNO2+H2O
NaNO3+NaNO2+H2O
任务1:利用如图所示装置探究NO2能否被NH3还原(K1、K2为止水夹,夹持固定装置略去)。
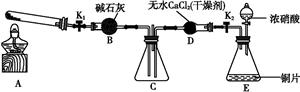
(1)E装置中制取NO2反应的化学方程式是? 。
(2)若NO2能够被NH3还原,预期观察到C装置中的现象是 ?。
(3)实验过程中,未能观察到C装置中的预期现象。该小组同学从反应原理的角度分析了原因,认为可能是:
①NH3还原性较弱,不能将NO2还原;
②在此条件下,NO2的转化率极低;
③ ?。
(4)此实验装置存在一个明显的缺陷是?。
任务2:探究NO2能否与Na2O2发生氧化还原反应。
(5)实验前,该小组同学提出三种假设。
假设1:二者不反应;
假设2:NO2能被Na2O2氧化;
假设3: 。
(6)为了验证假设2,该小组同学选用任务1中的B、D、E装置,将B中的药品更换为Na2O2,另选F装置(如图所示),重新组装,进行实验。

①装置的合理连接顺序是 ?。
②实验过程中,B装置中淡黄色粉末逐渐变成白色。经检验,该白色物质为纯净物,且无其他物质生成。推测B装置中反应的化学方程式为 。
4、选择题 14 mL二氧化氮和氨的混合气体在一定条件下充分反应,化学方程式是6NO2+8NH3====7N2+12H2O。已知该混合气体参加反应的二氧化氮比参加反应的氨少2 mL(气体体积均在相同状况下测定),则原混合气体中二氧化氮和氨的物质的量之比是(?)
A.3∶2
B.2∶3
C.3∶7
D.3∶4
5、选择题 一氯氨(NH2Cl)中氨基离子带负电荷,推测它跟水反应的最初生成物是(?)
A.NH3和HClO
B.NH2OH和HCl
C.NH3·H2O和HCl
D.NH3和HClO3