1、填空题 (6分)过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。回答下列有关双氧水的问题:
(1)下述反应中,H2O2仅体现氧化性的反应是(填代号)_________________。
A.Na2O2+2HCl=2NaCl+H2O2? B.Ag2O+H2O2=2Ag+O2↑+H2O
C.2H2O2=2H2O+O2↑? D.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
(2)保存过氧化氢的试剂瓶上最适合贴上的一个标签是___________(填代号)。

A、自燃物品? B、氧化剂? C、剧毒品? D、腐蚀品
(3)H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称,如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:KCN+ H2O2+ H2O = A+NH3↑,试指出生成物A的化学式为_____________。
参考答案:(每空2分,共6分)(1)D?(2)B?(3) KHCO3;
本题解析:(1)物质所含元素化合价降低,得到电子的反应是还原反应,该物质就做氧化剂。所以选项D正确,A中双氧水是生成物,且该反应不是氧化还原反应;B中双氧水是还原剂,C中双氧水既是氧化剂,也是还原剂,答案选D。
(2)过氧化氢是一种氧化剂,所以选项B正确,答案选B。
(3)根据原子守恒和电子守得失恒可知,生成物A应该是KHCO3。
本题难度:一般
2、选择题 下列有关物质结构的表述正确的是
A.次氯酸的电子式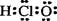
B.硫原子的最外层电子数为6
C.二氧化硅的分子式 SiO2
D.钠离子的结构示意图
参考答案:B
本题解析:考查常见化学用语都判断。次氯酸的电子式是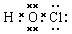 ,选项A不正确。二氧化硅形成的晶体是原子晶体,不存在分子,选项C不正确;钠离子只有2个电子层,最外层电子数是8个,选项D不正确,所以正确的答案选B。
,选项A不正确。二氧化硅形成的晶体是原子晶体,不存在分子,选项C不正确;钠离子只有2个电子层,最外层电子数是8个,选项D不正确,所以正确的答案选B。
本题难度:一般
3、选择题 下列说法正确的是:(?)
A.元素的单质一定是由还原该元素的化合物来制得
B.含有最高价元素的化合物不一定具有很强的氧化性
C.阳离子只能得到电子被还原,阴离子只能失去电子被氧化
D.在化学反应中,得电子越多的氧化剂,其氧化性就越强
参考答案:B
本题解析:元素的单质可能是还原该元素,也可能是氧化该元素的制得;阳离子和阴离子都可能得电子也可能失电子;在化学反应中得电子多少与氧化性没有必然联系。
本题难度:一般
4、填空题 (5分)北京市规定食盐中碘含量标准为(18~33)mg/kg。为测定加碘食盐样品的碘含量,某实验小组设计了如下步骤:
Ⅰ.用天平准确称取5.0 g食盐样品,加适量蒸馏水使其完全溶解。
Ⅱ.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全。
Ⅲ.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3 mol·L-1的Na2S2O3溶液3.0 mL,恰好反应完全。
(1)步骤Ⅱ中反应后碘元素以 形式(填物质的化学式)存在。
(2)已知步骤Ⅲ中S2O32-反应后转化为S4O62-,写出步骤Ⅲ的离子方程式 。
(3)上述实验样品中碘含量是 mg/kg。
参考答案:(1)I2(2分)(2)I2+2S2O32-=2I-+S4O62-(2分)(3)25.4(1分)
本题解析:(1)酸性条件下,碘酸根离子和碘离子发生氧化还原反应生成碘单质,离子反应方程式为:IO3-+5I-+6H+=3I2+3H2O;
(2)步骤Ⅲ中S2O32-反应后转化为S4O62-,I2转化为I-,离子方程式为:I2+2S2O32-=2I-+S4O62-;
(3)根据反应IO3-+5I-+6H+=3I2+3H2O, I2+2S2O32-=2I-+S4O62-,设碘酸钾中碘的质量是x,
IO3------3I2--------6S2O32
127g 6mol
x 2.0×10-3 mol?L-1×0.006L
x=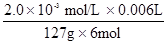 =0.254mg,每10g食盐中含有0.254mg碘,则每1Kg食盐中含有碘25.4mg。
=0.254mg,每10g食盐中含有0.254mg碘,则每1Kg食盐中含有碘25.4mg。
考点:考查氧化还原反应和相关计算。
本题难度:一般
5、填空题 (7分)根据要求回答下列问题
(1) ________________________________?(写名称)
________________________________?(写名称)
(2)2-甲基-2-戊烯?(写结构简式)
(3)键线式 表示的分子式??。
表示的分子式??。
(4)按官能团的不同,对有机物进行分类,请指出下列有机物的种类,填在横线上。
CH3CH2CH2Br? __________;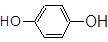 ___________;?
___________;? ________________;
________________; ________________;?
________________;?
参考答案:(1)2,3-二甲基戊烷?(2)(CH3)2C=CHCH2CH3?(3)C6H14?
(4)卤代烃?酚?酯?羧酸
本题解析:(1)根据有机物的结构简式可知,主链有5个碳原子,带两个支链,且都是甲基,所以名称是2,3-二甲基戊烷。
(2)根据名称可知,该有机物的结构简式为(CH3)2C=CHCH2CH3。
(3)将碳、氢元素符号省略,只表示分子中键的连接情况,每个拐点或终点均表示有1个碳原子,称为键线式。所以分子式为C6H14,名称是2-甲基戊烷。
(4)含有溴原子,则属于卤代烃。含有酚羟基,则是酚类。含有酯基则是酯类。含有羧基,则是羧酸类。
本题难度:一般