1、选择题 下列说法正确的是( ?)
A.铝合金的熔点比纯铝高
B.电解MgCl2溶液可获得金属镁
C.水晶项链和餐桌上的瓷盘都是硅酸盐制品
D.铜具有良好的导电性,常用来制作印刷电路板
参考答案:D
本题解析:合金的特点是熔点低、硬度大,A错误;电解熔融氯化镁才可以制备金属镁,B错误;水晶项链主要成分是二氧化硅,不是硅酸盐产品,C错误;铜有导电性,可以用于印刷电路板和铁离子反应,故D正确,选D。
本题难度:一般
2、选择题 下图是向MgCl2、AlCl3混合溶液中滴加7mL试剂A,之后改滴试剂B,所得沉淀ymol与试剂体积V(mL)间的关系.以下结论一定不正确的是(? )
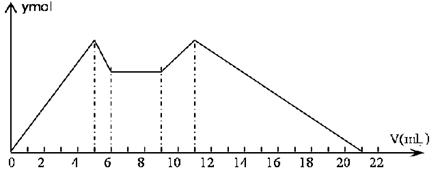 ?
?
A.从9到11mL,发生的反应:AlO2-+H++H2O=Al(OH)3↓
B.原混合液中,c(Al3+)∶c(Mg2+)∶c(Cl-)=1∶2∶5
C.A是NaOH,B是盐酸,且c(NaOH)∶c(HCl)=2∶1
D.从7到9mL,相应离子反应式为:H++OH-=H2O
参考答案:B
本题解析:从0到5mL,发生反应的离子方程式为:Al3++3OH-=Al(OH)3↓,Mg2++2OH-=Mg(OH)2↓。从5到9mL,发生反应的离子方程式为:Al(OH)3+OH-=AlO2-+H2O、H++OH-=H2O 。从9到11mL,发生反应的离子方程式为:AlO2-+H++H2O=Al(OH)3↓。从11到21mL,发生反应的离子方程式为:Al(OH)3+3H+=Al3++3H2O、Mg(OH)2+2H+=,Mg2++2H2O 。综上,答案选B。原混合溶液中,c(Al3+)∶c(Mg2+)∶c(Cl-)=1∶1∶5 。
点评:本题结合坐标图考查了金属与酸碱溶液的反应,属于难题。解题时,应读懂坐标图所表示的含义,以及写出各个曲线上所发生的化学反应的方程式。同时,应掌握相关物质之间的反应。
本题难度:一般
3、选择题 向含有amolAlCl3溶液中加入含有bmolKOH溶液,生成沉淀的物质的量可能是①amol②bmol③a/3mol④b/3mol⑤0mol⑥(4a-b)mol(? )?
A.①③④⑤⑥
B.①②③④⑤
C.①④⑤⑥
D.①④⑤
参考答案:A
本题解析:根据方程式知Al3++3OH-=Al(OH)3↓,Al(OH)3↓+OH-=AlO2-+2H2O知,生成的沉淀不可能为bmol。
本题难度:一般
4、计算题 在天平左右两边的托盘上,各放一个盛有等质量、等溶质质量分数的足量稀硫酸的烧杯,待天平平衡后,向两烧杯中分别加入铁和镁,若要使天平仍保持平衡,求所加铁和镁的质量比。
参考答案:铁与镁的质量比为77∶81时天平仍保持平衡
本题解析:①因硫酸足量,故铁和镁全参加反应。
Fe+H2SO4=FeSO4+H2↑
Mg+H2SO4=MgSO4+H2↑
②由化学方程式可知,影响天平两端质量变化的因素是加入的金属和生成的氢气。
③分别加入铁和镁后,只有当天平两端增加的质量相同时,天平才可仍保持平衡。解:设所加铁与镁的质量分别为x、y(此时天平两端增加的质量均为a)。
Fe+H2SO4=FeSO4+H2↑ 增加的质量(差量)
56? 2 ?56-2=54
x? ?a
Mg+H2SO4=MgSO4+H2↑ 增加的质量(差量)
24? 2 ?24-2=22
y ? ?a
56∶54= x∶a
24∶22=y∶a
当酸足量时,所加的铁与镁的质量比为77∶81时天平仍保持平衡。
本题难度:简单
5、选择题 为测定某镁铝合金样品中铝的含量,进行了下列实验:取一定量合金,加入100 mL 0.3 mol·L-1稀硫酸,合金完全溶解,产生的气体在标准状况下体积为560 mL;再加入0.2 mol·L-1 NaOH溶液至沉淀质量恰好不再变化,用去350 mL NaOH溶液。则所取样品中铝的物质的量为
A.0.005 mol
B.0.010 mol
C.0.020 mol
D.0.030 mol
参考答案:B
本题解析:本题考查镁铝合金与酸、碱反应的计算,意在考查考生对镁、铝性质的理解及化学计算能力。沉淀质量恰好不再变化,得到NaAlO2和Na2SO4溶液,根据S元素守恒,n(SO42- )=n(H2SO4)=0.1 L×0.3 mol·L-1=0.030 mol,根据Na元素守恒,则n(Na+)=n(NaOH)=0.2 mol·L-1×0.35 L=0.070 mol,则n(AlO2-)=0.070 mol-0.030 mol×2=0.010 mol,根据Al元素守恒,n(Al)=n(AlO2-)=0.010 mol,B项正确。
本题难度:一般