1、选择题 把a g 铝铁合金粉末溶于足量盐酸中,再加入过量氢氧化钠溶液。过滤出沉淀,经洗涤、干燥、灼烧,得到红棕色粉末的质量仍 为a g,则此合金中铝的质量分数为(?)
为a g,则此合金中铝的质量分数为(?)
A.70%
B.30%
C.52.4%
D.22.2%
2、选择题 下列氯化物中,能直接利用金属与稀盐酸反应得到的是
A.FeCl3
B.CuCl2
C.MgCl2
D.AgCl
3、计算题 将镁粉和碳酸镁的混合物置于氧气中灼烧,直至质量不再改变为止。经测定,灼烧后所 得固体质量与原混合物质量相同,求原混合物中镁粉和碳酸镁的质量比。
4、填空题 以水氯镁石(主要成分为MgCl2·6H2O)为原料生产碱式碳酸镁的主要流程如下:
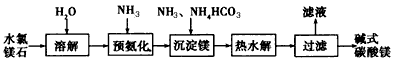
(1)预氨化过程中有Mg(OH)2沉淀生成,已知常温下Mg(OH)2的Ksp= 1.8×l0-11,若溶液中c(OH-) =3.0×10-6mol/L,则溶液中c(Mg2+)=_____
(2)上述流程中的滤液浓缩结晶,所得主要固体物质的化学式为____
(3)高温煅烧碱式碳酸镁得到MgO。取碱式碳酸镁4.66 g,高温煅烧至恒重,得到固体2.00 g和标准状况下CO20.896 L,通过计算确定碱式碳酸镁的化学式。_____________________________
(4)若热水解不完全,所得碱式碳酸镁中将混有MgCO3,则产品中镁的质量分数____(填“升高”、“降低”或“不变”)。
5、选择题 下列解释实验事实的化学方程式正确的是
A.5molFe和4molCl2反应:5Cl2+4Fe点燃2FeCl2+2FeCl3
B.2molKMnO4和3molH2O2在酸性条件下反应:2MnO4-+3H2O2+6H+=Mn2++4O2↑+6H2O
C.在电解液为氢氧化钾的甲醇燃料电池内电路中,阳极的电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O
D.向NaAlO2溶液中通入过量CO2:CO2+3H2O+2AlO2-=2Al(OH)3↓+CO32-