1、实验题 碘是人体必需的元素之一,海洋植物如海带、海藻中含有丰富的、以化合态形式存在的碘元素。在实验室中,从海藻里提取碘的流程和实验装置如下:
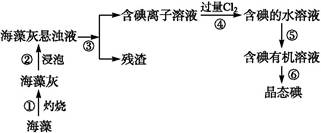
(1)指出上述提取碘的过程中有关实验操作的名称:步骤③ ,步骤⑤ 。?
(2)写出步骤④对应反应的离子方程式: 。?
(3)提取碘的过程中,可供选择的有机试剂是 。(填编号)?
A.酒精? B.醋酸? C.四氯化碳? D.苯
(4)步骤④除了加入过量Cl2,下列氧化剂最好选用 (填代号)。?
A.浓硫酸? B.H2O2溶液? C.KMnO4溶液
理由是____________________________。?
(5)为了使海藻灰中的碘离子转化为碘的有机溶液,即完成步骤③至⑤,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器和物品,尚缺少的玻璃仪器是 。?
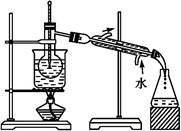
(6)从含碘的有机溶剂中提取碘和回收有机溶剂,还需要经过蒸馏。指出下图实验装置中存在的错误之处: 。?
2、选择题 下表是一些常用化学试剂的性质,根据表中所列信息选择的保存方法合适的是(?)
浓硝酸
| 白磷
| 金属钠
| 液溴
| 金属锂
|
易挥发;见光、受热易分解;易腐蚀橡胶
| 在空气中易被氧化,易自燃;难溶于水,易溶于二硫化碳;密度比水大
| 易与水、氧气等反应,与煤油、石蜡等不发生反应;密度小于水,大于煤油
| 极易挥发,不易溶于水,易腐蚀橡胶
| 易与水、氧气等反应,与煤油、石蜡等不发生反应;密度小于水和煤油
A.浓硝酸、液溴等试剂必须保存在玻璃塞的棕色试剂瓶中
B.金属钠和金属锂都应保存在煤油中,以隔绝空气
C.白磷和液溴都应用水封存
D.白磷和金属钠都可保存在二硫化碳中
|
题型:单选题难度:偏易来源:不详 答案 见光易分解的试剂,必须保存在棕色瓶中;易挥发、易与空气反应的物质保存时必须隔绝空气,可根据它们各自的性质用水封、油封或石蜡封存。根据表中所列信息,硝酸必须保存在棕色瓶中,其他物质没有必要保存在棕色瓶中。金属钠、金属锂、白磷易与空气反应,必须隔绝空气,因锂的密度比煤油的密度小,所以不能用煤油封存,只能用石蜡封存;金属钠可用煤油封存;白磷由于不与水反应,且密度比水大,故可用水封存;液溴极易挥发,所以必须密封,由于不易溶于水,所以可用水封。浓硝酸、液溴都易腐蚀橡胶,所以保存时必须用玻璃塞。
马上分享给同学