1、选择题 下列有关实验操作错误的是(?)
A.用药匙取用粉末状或小颗粒状固体
B.用胶头滴管滴加少量液体
C.给盛有2/3体积液体的试管加热
D.倾倒液体时试剂瓶标签面向手心
参考答案:C
本题解析:考查基本实验操作。给试管中的液体加热时,液体的体积不能超过试管容积的1/3,选项C是错误的,答案选C。
本题难度:简单
2、选择题 配制250mL 0.10mol/L的NaOH溶液时,下列实验操作会使配得的溶液浓度偏大的是(?)
A.转移溶液后未洗涤烧杯和玻璃棒就直接定容
B.移液前容量瓶中有少量蒸馏水
C.在容量瓶中进行定容时俯视刻度线
D.定容后把容量瓶倒转摇匀,发现液面低于刻度,再补充几滴水至刻度
参考答案:C
本题解析:A.转移溶液后未洗涤烧杯和玻璃棒,就会有一部分溶质没有完全转移到容量瓶中。若直接定容,则由于溶质的物质的量减少,所配制的溶液浓度偏低。错误。B.移液前容量瓶中有少量蒸馏水。由于溶质的物质的量没变,溶剂的体积也没有变化,所以对溶液的浓度无影响。错误。C.若在容量瓶中进行定容时俯视刻度线,则所配制的溶液的体积偏小,由于溶质的物质的量没有变化,所以溶液的浓度就偏大。正确。D.定容后把容量瓶倒转摇匀,如果发现液面低于刻度,那是因为有一部分溶液附着在容量瓶的瓶颈上。由于溶液由均一性、稳定性。所以浓度没有变化。若再补充几滴水至刻度反而对溶液起到了稀释作用。致使溶液的浓度偏低。错误。
本题难度:一般
3、选择题 下列实验操作中,错误的是( )
A.配制5%的食盐溶液时,将称量的食盐放在烧杯中加适量的蒸馏水搅拌溶解
B.用酸式滴定管准确量取10.00mLKMnO4溶液
C.用500mL容量瓶配制1mol/L的NaOH溶液
D.用pH试纸测得新制氯水的pH为2
参考答案:A、配制5%的食盐溶液,根据称量的食盐质量计算溶液的质量,进而计算需要水的质量,将称量的食盐放在烧杯中加适量的蒸馏水搅拌溶解即可,故A正确;
B、高锰酸钾具有强氧化性,可以腐蚀橡皮管,故应用酸式滴定管量取,滴定管的精度为0.01mL,可以准确量取10.00mL溶液,故B正确;
C、将20.0g氢氧化钠溶解,冷却后转移到500mL容量瓶定容,所得溶液的浓度为1mol/L,故C正确;
D、氯水有强氧化性,具有漂白性,将新制氯水滴在pH试纸上先变红,红色立即褪去,故不能测定新制氯水的pH值,故D错误;
故选D.
本题解析:
本题难度:简单
4、实验题 某光卤石(KCl·MgCl2·6H2O)样品中含有不跟NaOH溶液和盐酸反应的杂质,某校化学课外活动研究小组现欲测定此样品中含KCl·MgCl2·6H2O的质量分数,经讨论有多种实验测定方案。
请根据提供的实验试剂和仪器(所需的仪器任选),选择精确度较高的实验测定方案,简要写出第二步以后的实验步骤和实验结果。
一、可选用的实验试剂:
(1)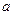 mol·L
mol·L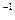 NaOH溶液? (2)
NaOH溶液? (2)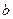 mol·L
mol·L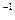 Na2CO3溶液? (3)c mol·L
Na2CO3溶液? (3)c mol·L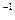 ?HCl溶液
?HCl溶液
(4)d mol·L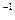 AgNO3溶液? (5)酚酞试液? (6)甲基橙试液
AgNO3溶液? (5)酚酞试液? (6)甲基橙试液
二、实验步骤:
第一步:称取m g样品,放入250mL烧杯中,加适量水溶解
第二步:
计算样品中含KCl·MgCl2·6H2O(相对分子质量为277.5)的质量分数的表达式:
?。
参考答案:第二步:加入A mL 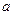 mol·L
mol·L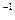 NaOH溶液(过量),充分反应;第三步:直接在反应后的溶液中滴加酚酞指示剂2~3滴;第四步:用c mol·L
NaOH溶液(过量),充分反应;第三步:直接在反应后的溶液中滴加酚酞指示剂2~3滴;第四步:用c mol·L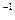 HCl溶液滴定至由浅红色变为无色且在半分钟内不再变色,消耗HCl溶液B mL.
HCl溶液滴定至由浅红色变为无色且在半分钟内不再变色,消耗HCl溶液B mL.
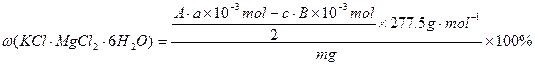
本题解析:1.实验原理:根据KCl·MgCl2·6H2O的性质,可加入足量的NaOH溶液,再从所加试剂的量入手,或可用生成沉淀的质量进行计算来求得.? 2.由实验操作的难易确定最佳途径:①测定沉淀的质量:需要过滤、洗涤、烘干,步骤多,误差较大;②测定所加试剂的量:可通过滴定法,精确度较高,操作较简便.由此可见,方法②为最佳途径.? 3.再由细节,求完善:(1)为了使沉淀完全,沉淀剂必须过量;过量的试剂必须准确测出,涉及的实验步骤要尽可能少.? (2)中和滴定中指示剂的选择也很关键,仅仅从中和反应本身来讲,甲基橙、酚酞皆可用,但在此实验中影响到实验操作的难易,如选甲基橙作滴定过量碱的指示剂,就必须对生成的Mg(OH)2沉淀进行过滤、洗涤且将洗涤液合并后,再进行滴定;如选酚酞试液作指示剂,Mg(OH)2沉淀就无需过滤,因为酚酞变色范围在pH=8~10,滴定到终点时Mg(OH)2沉淀不会溶解.显然,用酚酞作指示剂简化了实验步骤,提高了实验的精确度,所以应选用酚酞作为测定过量的NaOH的指示剂。
本题难度:一般
5、选择题 有NaCl、KSCN、NaOH、AgNO3四种溶液,只用一种试剂就能把它们鉴别,这种试剂是( )
A.盐酸
B.Na2CO3溶液
C.氯水
D.FeCl3溶液
参考答案:D
本题解析:FeCl3溶液与KSCN呈现血红色,与NaOH生成红褐色沉淀,与AgNO3生成沉淀。
本题难度:简单