1、选择题 把金属A和金属C分别投入到等浓度的盐酸中,A比C反应剧烈;A与金属B组成原电池时,A为电池的正极。A、B、C三种金属的活动性顺序为
A.A>C>B B.A>B>C C.B>A>C D.B>C>A
参考答案:C
本题解析:金属越活泼,越容易和盐酸反应,反应就越剧烈,所以A的金属性强于C的;原电池中较活泼的金属是负极,失去电子,发生氧化反应,所以根据A与金属B组成原电池时,A为电池的正极可知,金属性是B大于A,则A、B、C三种金属的活动性顺序为B>A>C,答案选C。
考点:考查元素金属性强弱的判断
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,难易适中。在注重对基础知识巩固和训练的同时,侧重对学生能力的培养和训练。该题的关键是明确金属性强弱比较的规律,特别是利用原电池原理比较金属性强弱的规律,有利于培养学生的逻辑推理能力和发散思维能力。
本题难度:简单
2、填空题 (1)在下图的装置中,属于原电池的是____________
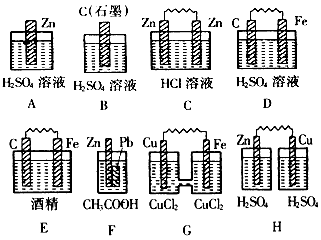
(2)以锌、石墨棒为两极,硫酸铜溶液为电解液组成的原电池的正极反应式是____________________
负极反应式是____________________。
参考答案:(1)DFG
(2)Cu2++2e-==Cu;Zn-2e-==Zn2+
本题解析:
本题难度:一般
3、选择题 在理论上不能用于设计原电池的化学反应是
[? ]
A.H2SO4(aq)+BaCl2(aq)=2HCl(aq)+BaSO4(s) ΔH<0
B.2CH3OH(l)+3O2(g)→2CO2(g)+4H2O(l) ΔH<0
C.4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s) ΔH<0
D.3Cu(s)+8HNO3(aq)=3Cu(NO3)2(aq)+2NO(g)+4H2O(l) ΔH<0
参考答案:A
本题解析:
本题难度:简单
4、选择题 下列说法错误的是
A.铅蓄电池在放电过程中,负极质量最终减小,正极质量最终增加
B.放热反应不一定能自发进行
C.一定条件下,使用催化剂能加快反应速率,但不能提高反应物的平衡转化率
D.温度一定,当溶液中Ag+和Cl-浓渡的乘积等于Ksp时,溶液为AgCl的饱和溶液
参考答案:A
本题解析:负极 Pb+SO42-=PbSO4+2e?正极 PbO2+4H++SO42-+2e=PbSO4+2H2O
A.铅蓄电池在放电过程中,负极质量最终增加,正极质量最终增加,
本题难度:简单
5、填空题 (12分)铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为:Pb+PbO2+4H++2SO42-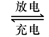 2PbSO4+2H2O回答下列问题(不考虑氢、氧的氧化还原)
2PbSO4+2H2O回答下列问题(不考虑氢、氧的氧化还原)
(1)放电时:正极的电极反应式是?;电解液中H2SO4的浓度将变________,当外电路通过1mol电子时,理论上负极板的质量增加?g。
(2)在完全放电耗尽PbO2和Pb时,若按右图连接,电解一段时间后,则在A电极上生成__________,B电极上生成________,此时铅蓄电池的正负极的极性将____________。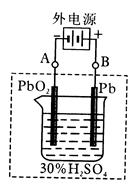
参考答案:(1)PbO2 + 2e- + 4H+ +SO42- = PbSO4 + 2H2O?小? 48
(2)Pb? PbO2?对换
本题解析:考查原电池和电解池的判断及有关计算。
(1)放电相当于原电池,充电相当于电解池。原电池中正极是得到电子,发生还原反应的,根据总反应式可知铅是负极,二氧化铅是正极。所以蓄电池中正极电极反应式为PbO2 + 2e- + 4H+ +SO42-= PbSO4 + 2H2O。放电时消耗硫酸,因此硫酸浓度将减小。负极电极反应式为Pb-2e-+SO42-= PbSO4,所以通过1mol电子时,负极质量增加为0.5mol×303g/mol-0.5mol×207g/mol=48g。
(2)根据装置图可判断A和电源的负极相连,作阴极,得到电子发生还原反应,电极反应式为PbSO4+2e-=Pb+SO42-。B和电源的正极相连,作阳极,失去电子发生氧化反应,电极反应式为PbSO4-2e-+ 2H2O = PbO2 + 4H+ +SO42-。所以A极生成铅,B极生成二氧化铅,因此蓄电池的正负极的极性将对换。
本题难度:一般