1、选择题 除去NaCl中混有的MgCl2、Na2SO4选用的化学药品是()
A.NaOH 和Ba(NO3)2
B.Ca(OH)2和AgNO3
C.NaOH和BaCl2
D.Na2CO3和BaCl2
参考答案:C
本题解析:考查物质的分离与提纯。镁离子用氢氧化钠除去,SO42-用氯化钡除去,,最后加入盐酸酸化,所以正确的答案选C
本题难度:简单
2、简答题 欲降低废水中重金属元素铬的毒性,可将Cr2O72-转化为Cr(OH)3沉淀除去.三种金属离子生成沉淀的pH如表.
| 开始沉淀的pH | 完全沉淀的pH
Fe(OH)2
7.0
9.0
Fe(OH)3
1.9
3.2
Cr(OH)3
6.0
8.0
|
(1)某含铬废水处理的主要流程如图所示:
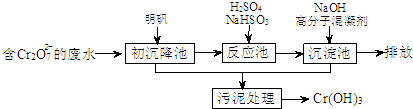
①初沉池中加入明矾作沉降剂,其作用的原理是(用离子方程式表示)______.
②请补充并配平以下反应池中发生主要反应的离子方程式:
______Cr2O72-+______HSO3-+______═______Cr3++______SO42-+______H2O.
③根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是:H++OH-=H2O和______.证明Cr3+沉淀完全的方法是______.
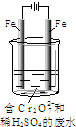
(2)工业可用电解法来处理含Cr2O72-废水.实验室利用如图模拟处理含Cr2O72-的废水,阳极反应是Fe-2e-=Fe2+,阴极反应式是2H++2e-=H2↑.
①Fe2+与酸性溶液中的Cr2O72-反应的离子方程式是______,
②上述反应得到的金属阳离子在阴极区可沉淀完全,从其对水的电离平衡角度解释其原因______.
③若溶液中含有0.01molCr2O72-,则阳离子全部生成沉淀的物质的量是______mol.
参考答案:(1)①K2SO4﹒Al2(SO4)3﹒24H2O为强电解质,在溶液中完全电离,生成Al3+和SO42-、K+,Al3+能水解生成氢氧化铝胶体:Al3++3H2O=Al(OH)3(胶体)+3H+或Al3++3H2O?Al(OH)3+3H+,氢氧化铝胶体具有吸附性,能吸附水中的悬浮物,所以能作净水剂,
故答案为:Al3++3H2O?Al(OH)3+3H+;
②反应中,Cr2O72-中铬元素化合价变化为:+6→+3,化合价降低了3价,Cr2O72-中含有两个铬原子,至少降低6价;
HSO3-中硫元素化合价变化为:+4→+6,化合价升高了(6-4)=2价,化合价变化的最小公倍数为6,所以Cr2O72-的化学计量数为1,亚硫酸氢根离子计量数为3,铬离子计量数为2,硫酸根离子计量数为3,再根据电荷守恒,氢离子计量数为5,最后根据质量守恒判断,未知物为水,计量数为4,配平后的方程式为:Cr2O72-+3HSO3-+5H+═2Cr3++3SO42-+4H2O,
故答案为:1;3;5;2;3;4;
③向转化后的废水中加入NaOH溶液,NaOH会和H+发生反应H++OH-═H2O,Cr3+与NaOH发生反应Cr3++3OH-═Cr(OH)3↓,根据表中数据可知,Cr(OH)3沉淀完全时,溶液的pH为8,所以测定溶液的pH,若pH≥8,则证明Cr3+沉淀完全,
故答案为:Cr3++3OH-=Cr(OH)3↓;取沉淀后的上层清液测定其pH,若pH≥8,则沉淀完全;
(2)①亚铁离子与Cr2O72-发生氧化还原反应,Cr2O72-被还原为Cr3+,然后Cr3+生成Cr(OH)3沉淀,重铬酸根具有强氧化性,能将生成的亚铁离子氧化为三价,反应的离子方程式为:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,
故答案为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
②随着电解进行,溶液中c(H+) 逐渐减少,打破了水的电离平衡,促进了水的电离,使溶液中OH-浓度增大,溶液的碱性增强,生成Fe(OH)3和Cr(OH)3沉淀,金属阳离子在阴极区可沉淀完全,
故答案为:水中的H+在阴极区放电,H+浓度减小促使水的电离平衡H2O?H++OH-向右移动,阴极区OH-浓度增大与金属阳离子在阴极区结合而沉淀完全;
③根据Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,Cr3++3OH-═Cr(OH)3↓、Fe3++3OH-═Fe(OH)3↓知0.01mol Cr2O72-,可生成0.02molCr(OH)3,0.06molFe(OH)3,共0.08mol,
故答案为:0.08.
本题解析:
本题难度:一般
3、实验题 某研究性学习小组做实验时偶然发现,表面擦去氧化膜的镁片可与NaHCO3溶液反应产生大量气体和白色不溶物。该小组同学通过如下实验,验证产物并探究反应原理。
实验①:用砂纸擦去镁条表面氧化膜,将其放入盛适量滴有酚酞试液的饱和碳酸氢钠溶液的烧杯中,迅速反应,产生大量气泡和白色不溶物,溶液的浅红色加深。
Ⅰ、定性实验
(1)气体的检验?
实验②:将实验①中收集到的气体点燃,发现气体安静燃烧,火焰呈淡蓝色。则气体为?。
(2)该小组同学对反应中产生的白色不溶物做出如下猜测:
猜测1:白色不溶物可能为 ??
猜测2:白色不溶物可能为MgCO3
猜测3:白色不溶物可能为碱式碳酸镁[yMg(OH)2?xMgCO3]
请设计一个实验检验固体中是否含有MgCO3,写出实验操作、现象和结论:?。
(3)实验③:取实验①中的滤液,向其中加入少量CaCl2稀溶液,产生白色沉淀,溶液红色变浅,说明溶液中存在CO32-离子。
Ⅱ、定量实验
(4)为进一步确定实验I的白色不溶物的成分,进行以下定实验,装置如图所示:

称取干燥、纯净的白色不溶物 7.36 g,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置A和B中。实验后装置A增重0.72g,装置B增重2.64 g。白色不溶物的化学式为?。
(5)写出镁与饱和碳酸氢钠溶液反应的化学方程式?。
Ⅲ、反应原理分析
(6)NaHCO3溶液中存在如下电离平衡:H2O H+ + OH-、HCO3-
H+ + OH-、HCO3- H+ +CO32-,请从平衡移动角度分析实验①产生大量气体和白色不溶物的原因:?。
H+ +CO32-,请从平衡移动角度分析实验①产生大量气体和白色不溶物的原因:?。
参考答案:(1)氢气(或H2)(2分)
(2)Mg(OH)2(2分)取少许实验①固体,加足量稀盐酸,若有气泡产生,则含有MgCO3。反之,则无。(2分)
(4)2Mg(OH)2?3MgCO3或Mg5(OH)4(CO3)3 (2分)
(5)5Mg+6NaHCO3+4H2O= 2Mg(OH)2? 3MgCO3↓+3Na2CO3+5H2↑(2分)
(6)Mg和H+反应生成H2和Mg2+,Mg2+跟OH-、CO32-结合生成沉淀,则H+、OH-、CO32-的浓度均降低,上述平衡均向右移动。所以Mg和饱和NaHCO3溶液反应产生大量气体和白色不溶物。(3分)
本题解析:(1)将实验①中收集到的气体点燃,发现气体安静燃烧,火焰呈淡蓝色,说明该气体具有可燃性,再根据质量守恒定律反应前后元素种类不变可分析出是氢气。
(2)根据元素守恒和物质的溶解性可知:白色不溶物可能是Mg(OH)2?或MgCO3或Mg(OH)2与MgCO3,故猜测1为Mg(OH)2;根据碳酸盐的性质,能与强酸反应生成CO2气体,所以检验是否含有MgCO3的方法为:取少许实验①固体,加足量稀盐酸,若有气泡产生,则含有MgCO3。反之,则无。
(4)B中碱石灰质量的增加量就是生成的二氧化碳的质量,所以生成二氧化碳的质量为2.64g,设含MgCO3的质量为x,则:
MgCO3+2HCl═MgCl2+H2O+CO2↑
84?44
X? 2.64g
可得:84:44=x:2.64g,解得x=5.04g,所以含Mg(OH)2的质量为:7.36g—5.04g=2.32g,Mg(OH)2与MgCO3的物质的量之比为:2.32g÷58g/mol:(5.04g÷84g/mol)=0.4mol:0.6mol=2:3,所以白色不溶物的化学式为:2Mg(OH)2?3MgCO3或Mg5(OH)4(CO3)3
(5)根据上述探究实验可知,镁与饱和碳酸氢钠溶液反应,生成了2Mg(OH)2?3MgCO3和H2,根据元素守,恒,还会生成Na2CO3,所以化学方程式为:5Mg+6NaHCO3+4H2O = 2Mg(OH)2? 3MgCO3↓+3Na2CO3+5H2↑。
(6)NaHCO3溶液中存在如下电离平衡:H2O H+ + OH-、HCO3-
H+ + OH-、HCO3- H+ +CO32-,镁是活泼金属,能与H+反应,生成Mg2+和H2,Mg2+能与OH?结合成Mg(OH)2沉淀,Mg2+还能与CO32?结合成MgCO3沉淀,H+、OH-、CO32-的浓度均降低,上述平衡均向右移动。所以Mg和饱和NaHCO3溶液反应产生大量气体和白色不溶物。
H+ +CO32-,镁是活泼金属,能与H+反应,生成Mg2+和H2,Mg2+能与OH?结合成Mg(OH)2沉淀,Mg2+还能与CO32?结合成MgCO3沉淀,H+、OH-、CO32-的浓度均降低,上述平衡均向右移动。所以Mg和饱和NaHCO3溶液反应产生大量气体和白色不溶物。
本题难度:困难
4、选择题 下列实验结论中正确的是
选项
| 实验操作及现象
| 实验结论
|
A
| 向某溶液中加入滴加BaCl2溶液,立即产生白色沉淀。
| 原溶液中一定有SO42-
|
B
| 在K2CrO7溶液中加入NaOH溶液,溶液由橙色变为黄色。
| K2CrO7与NaOH溶液发生了氧化还原反应
|
C
| 在滴有酚酞的Na2CO3溶液中,滴加入BaC12溶液,溶液红色逐渐褪去。
| Na2CO3溶液中存在水解平衡?
|
D
| 用铂丝蘸取溶液进行颜色反应,观察到火焰呈黄色。
| 该溶液一定是钠盐溶液?
|
?
参考答案:C
本题解析:加入BaCl2溶液,生成不溶于稀HNO3的白色沉淀,白色沉淀可能是硫酸钡或氯化银,所以不能证明该溶液中一定含SO42-,故A错误;在水溶液中橙红色的Cr2O72-与黄色的CrO42-有下列平衡关系:Cr2O72-+H2O 2CrO42-+2H+,K2Cr2O7溶液呈橙色,加入少量NaOH固体,中和氢离子,氢离子浓度降低,平衡向右移动,溶液呈黄色,所以K2CrO7与NaOH溶液没有发生氧化还原反应,故B错误;碳酸钠水解呈碱性,加入BaC12溶液,生成碳酸钡沉淀,平衡向逆方向移动,如溶液褪色,可说明Na2CO3溶液中存在水解平衡,故C正确;钠离子的焰色反应为黄色,钾离子的焰色反应为紫色,会被钠离子的黄色所掩蔽,所以焰色反应为黄色,说明一定含Na+也可含K+。
2CrO42-+2H+,K2Cr2O7溶液呈橙色,加入少量NaOH固体,中和氢离子,氢离子浓度降低,平衡向右移动,溶液呈黄色,所以K2CrO7与NaOH溶液没有发生氧化还原反应,故B错误;碳酸钠水解呈碱性,加入BaC12溶液,生成碳酸钡沉淀,平衡向逆方向移动,如溶液褪色,可说明Na2CO3溶液中存在水解平衡,故C正确;钠离子的焰色反应为黄色,钾离子的焰色反应为紫色,会被钠离子的黄色所掩蔽,所以焰色反应为黄色,说明一定含Na+也可含K+。
本题难度:简单
5、选择题 下列有关实验的结论正确的是
选项
| 实验操作及现象
| 实验结论
|
A
| 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成
| 溶液中一定含有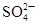
|
B
| 向某溶液中加入盐酸,产生能使澄清石灰水变浑浊的无色气体
| 溶液中一定含有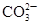
|
C
| 用酸度计测定SO2和CO2饱和溶液的pH,前者pH小
| H2SO3酸性强于H2CO3
|
D
| 用玻璃棒蘸取浓氨水点到红色石蕊试纸上,试纸变蓝色
| 浓氨水呈碱性
|
?
参考答案:D
本题解析:A、可能有银离子干扰,会产生不溶于酸的氯化银沉淀,错误;B、产生能使澄清石灰水变浑浊的无色气体可能是CO32-、HCO3-、SO32-、HSO3-,错误;C、SO2和CO2饱和溶液的浓度不同,前者浓度大,故溶液pH的大小不能判断酸性的强弱,错误;D、正确。
本题难度:一般