1、实验题 某待测溶液中可能含有Fe2+、Fe3+、Al3+、Ag+、Ba2+、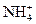 、Ca2+等,进行以下实验(所加酸、碱、氨水、溴水都是过量的)。
、Ca2+等,进行以下实验(所加酸、碱、氨水、溴水都是过量的)。

根据实验结果:
(1)判断待测液中有无Ba2+、Ca2+,并写出理由____________________。
(2)写出沉淀D的化学式__________。
(3)写出从溶液D生成沉淀E的反应的离子方程式:____________________。
参考答案:(1)含有Ba2+、Ca2+中的一种或两种,理由是BaSO4不溶于水,CaSO4微溶于水
(2)Fe(OH)3
(3)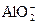 +CO2+2H2O ="===" Al(OH)3↓+
+CO2+2H2O ="===" Al(OH)3↓+
本题解析:加入稀盐酸产生了不溶于稀硝酸的沉淀,说明待测液中含有Ag+;溶液中加稀硫酸和Br2,Br2作氧化剂可以氧化Fe2+,产生的白色沉淀可能是BaSO4或CaSO4或两者都有;溶液中通NH3产生了沉淀,加碱后沉淀部分溶解,说明沉淀中含有Al(OH)3和Fe(OH)3。
本题难度:简单
2、选择题 用括号内试剂除去下列各物质中的少量杂质,正确的是
A.溴苯中的溴(KI溶液)
B.溴乙烷中的乙醇(水)
C.乙酸乙酯中的乙酸(饱和Na2CO3溶液)
D.硬脂酸中的油酸(Br2水)
参考答案:C
本题解析:略
本题难度:简单
3、选择题 下列说法正确的是
A.2mol的盐酸
B.0.1mol氢
C.0.3molHCl
D.4mol的氧元素
参考答案:C
本题解析:物质的量表示含有一定数目粒子的集合体,其单位是mol。在用表示微粒时,一般用化学式表示,而不用名称,所以选项C正确,其余都是错误的,答案选C。
本题难度:简单
4、选择题 下列化学实验事实及其解释都正确的是( )
①向碘水中滴加CCl4,振荡静置后分层,CCl4层呈紫红色,说明可用CCl4从碘水中萃取碘
②向SO2水溶液中滴加盐酸酸化的BaCl2溶液,有白色沉淀生成,说明BaSO3难溶于盐酸
③向0.1? mol/L FeSO4溶液中滴加少量酸性KMnO4溶液,KMnO4溶液褪色,说明Fe2+具有氧化性
④向2.0 mL浓度均为0.1? mol/L的KCl、KI混合溶液中滴加1~2滴0.01? mol/L AgNO3溶液,振荡,沉淀呈黄色,说明AgCl的Ksp比AgI的Ksp大
A.①②
B.①④
C.②③
D.③④
参考答案:B
本题解析:向SO2水溶液中加入盐酸酸化的BaCl2溶液,没有白色沉淀生成,因为BaSO3易溶于盐酸,②错误;FeSO4溶液遇酸性KMnO4溶液使其褪色,说明Fe2+具有还原性,③错误;①、④正确。
本题难度:一般
5、选择题 已知Na2SO4和NaCl混合溶液中,Cl-的物质的量浓度是Na+的物质的量浓度的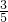 倍,下列叙述中正确的是
倍,下列叙述中正确的是
A.溶液中一定有1molNa2SO4和3molNaCl
B.所带电荷数SO42-是Na+的倍
C.SO42-与Cl-的物质的量之和等于Na+的物质的量
D.Na2SO4和NaCl的物质的量之比为1:3
参考答案:D
本题解析:分析:A、未给出溶液体积,无法得到具体的物质的量;
B、根据溶液呈电中性,阴阳离子所带电荷相等判断;
C、根据溶液呈电中性,阴阳离子所带电荷相等判断;
D、根据溶液呈电中性,阴阳离子所带电荷相等判断.
解答:A、未给出溶液体积,无法得到具体的物质的量,故A错误;
B、溶液呈电中性,由电荷守恒,所以2Q(SO42-)+Q(Cl-)=Q(Na+),由于Cl-的物质的量浓度是Na+的物质的量浓度的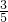 倍,所以Q(Cl-)=
倍,所以Q(Cl-)=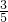 Q(Na+),使用Q(SO42-)=
Q(Na+),使用Q(SO42-)=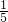 Q(Na+),故B错误;
Q(Na+),故B错误;
C、溶液呈电中性,阴阳离子所带电荷总数相等,所以2n(SO42-)+n(Cl-)=n(Na+),故C错误;
D、溶液呈电中性,阴阳离子所带电荷总数相等,所以2n(SO42-)+n(Cl-)=n(Na+),由于Cl-的物质的量浓度是Na+的物质的量浓度的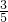 倍,所以n(Cl-)=
倍,所以n(Cl-)=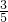 n(Na+),则n(SO42-)=
n(Na+),则n(SO42-)=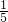 n(Na+),所以Na2SO4和NaCl的物质的量之比为1:3,故D正确.
n(Na+),所以Na2SO4和NaCl的物质的量之比为1:3,故D正确.
故选D.
点评:本题考查物质的量浓度的有关计算,难度不大,关键明白溶液呈电中性,阴阳离子所带电荷总数相等.
本题难度:一般