1、选择题 设阿伏加德罗常数为NA,则下列说法正确的是
A.5.6 g 铁在足量氯气中燃烧,电子转移0.2 NA个
B.1.12 L氯气中含有0.1 NA个氯原子
C.标准状况下,22.4L的溴单质含NA个溴分子
D.常温常压下,1L 0.1mol/L MgCl2溶液中含Cl—离子数为0.2NA
参考答案:D
本题解析:A选项中,可变价金属与氯气反应应生成高价金属氯化物,所以单质铁应变成三价铁,电子转移个数为0.3NA.B选项没有提供相应温度压强条件,所以在只知道气体体积的情况下无法得到该气体的物质的量.C选项标准状况下的溴应为液体,不能采用标况下的气体摩尔体积作为计算依据.D选项正确.
本题难度:简单
2、选择题 假设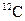 的相对原子质量为24,则下列推断不正确的是( )
的相对原子质量为24,则下列推断不正确的是( )
A.标准状况时11.2 的质量为32g
的质量为32g
B.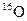 的相对原子质量为32
的相对原子质量为32
C.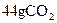 和28gCO含有相同的分子数
和28gCO含有相同的分子数
D.标准状况时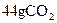 的体积是22.4L
的体积是22.4L
参考答案:A
本题解析:本题考查学生的抽象思维能力.依题意相对原子质量标准变为原来的 ,B正确.而气体的密度不会改变,A错,D对.每个气体分子的实际质量更不会改变,C对.
,B正确.而气体的密度不会改变,A错,D对.每个气体分子的实际质量更不会改变,C对.
本题难度:简单
3、选择题 将H2、N2、O2三种气体分别放入不同容器中,使它们的温度、密度相同,则其压强(p)大小的关系,符合( )
A.p(H2)>p(O2)>p(N2)
B.p(O2)>p(N2)>p(H2)
C.p(H2)>p(N2)>p(O2)
D.p(N2)>p(O2)>p(H2)
参考答案:相同温度下,气体的压强与物质的量呈正比,由ρ=mV可知单位体积的质量相同,由n=mM可知,气体的M越小在,则物质的量越大,压强越大,
因M(O2)>M(N2)>M(H2),
则p(H2)>p(N2)>p(O2),
故选C.
本题解析:
本题难度:一般
4、选择题 用NA表示阿伏加德罗常数的值。下列叙述正确的是?
A.常温常压下,1molC2H4所含的电子数为12 NA
B.标准状况下,16g甲烷中共价键数目为4NA
C.常温常压,4 g氦气所含的核外电子数为4NA
D.标准状况下,22.4L NO 与11.2L O2充分反应后,所得的气体分子数一定为NA
参考答案:B
本题解析:常温常压下,1molC2H4所含的电子数为16NA,A不正确;标准状况下,16g甲烷的物质的量是1mol,其中共价键数目为4NA,B正确;常温常压,4 g氦气的物质的量是1mol,所含的核外电子数为2NA,C不正确;标准状况下,22.4L NO 与11.2L O2充分反应后生成22.4LNO2,但NO2分子和N2O4存在平衡,即2NO2 N2O4,因此所得的气体分子数小于NA,D不正确,答案选B。
N2O4,因此所得的气体分子数小于NA,D不正确,答案选B。
点评:阿伏加德罗常数是历年高考的“热点”问题,为高考必考题目,这是由于它既考查了学生对物质的量、粒子数、质量、体积等与阿伏加德罗常数关系的理解,又可以涵盖多角度的化学知识内容。要准确解答好这类题目,一是要掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系;二是要准确弄清分子、原子、原子核内质子中子及核外电子的构成关系。
本题难度:简单
5、选择题 用NA表示阿伏加德罗常数的值,下列叙述中正确的是
A.100mL 0.1mol·L-1的稀硫酸中含有H+个数为0.1NA
B.1molNH4+中含有的电子数为11NA
C.27g金属铝与足量的氢氧化钠溶液反应,铝失去的电子数为3NA
D.常温常压下,11.2 L NO2 含有的原子个数为1.5 NA
参考答案:C
本题解析:100mL 0.1mol·L-1的稀硫酸中含有H+个数为0.1L× 0.1mol·L-1=0.01mol;1mol
NH4+中含有的电子数为10NA;27g铝为1mol,在反应中失去3mol电子;常温常压下,11.2 LNO2 的物质的量<0.5mol,含有的原子个数<1.5 NA。因此C正确。
本题难度:一般