1、选择题 六种短周期主族元素A、B、C、D、E、F的原子序数依次增大,其中A与E周主族,B与F同主族.已知常温下单质A与E的状态不同,D的核电荷数是B的最外层电子数的2倍,单质F是一种重要的半导体材料,则下列推断正确的是( )
A.由A、C、D三种元素组成的化合物一定是共价化合物
B.原子半径由大到小的顺序是:E>F>C>D
C.B、C、E、F四种元素的最高价氧化物对应的水化物酸性最强的是B,碱性最强的是E
D.元素的非金属性由强到弱的顺序是:D>C>F>B
参考答案:B
本题解析:
本题难度:简单
2、填空题 原子序数为13的元素位于元素周期表中第______周期、______族,其原子结构示意图为______.
参考答案:原子序数为13的元素,质子数为13,核外电子数为13,有3个电子层,最外层有3个电子,位于周期表中第三周期第ⅢA族;原子结构示意图为
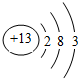
.
故答案为:三;ⅢA;

.
本题解析:
本题难度:一般
3、选择题 X、Y、Z三种短周期元素,X元素的原子最外层只有一个电子,Y元素的原子M电子层的电子数为K、L上电子总数的一半,Z元素的原子L层电子数比Y原子L层电子数少2个,由这三种元素组成的化合物的化学式可能是( )
A.X3YZ4
B.X2YZ3
C.XYZ2
D.X2YZ4
参考答案:AC
本题解析:
本题难度:一般
4、选择题 原子核外最外层电子数比次外层电子数多3个的元素符号是
[? ]
A.B
B.N
C.P
D.Al
参考答案:B
本题解析:
本题难度:简单
5、选择题 X、Y、Z、W是分别位于第2、3周期的元素,原子序数依次递增.X与Z位于同一主族,Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Z原子的最外层电子数是次外层电子数的一半,Y、Z、W原子的最外层电子数之和为14.下列说法正确的是( )
A.原子半径由小到大的顺序:X<Y<Z<W
B.Z的最高价氧化物能与水反应生成相应的酸
C.Y单质在一定条件下可以与氧化铁发生置换反应
D.室温下,0.1?mol/L?W的气态氢化物的水溶液的pH>1
参考答案:X、Y、Z、W是分别位于第2、3周期的元素,原子序数依次递增.Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Y为Al元素;Z原子的最外层电子数是次外层电子数的一半,Z为Si元素,X与Z位于同一主族,则X为C元素;Y、Z、W原子的最外层电子数之和为14,则W的最外层电子数为14-3-4=7,且原子序数最大,W为Cl元素.
A、C元素位于第二周期,其它元素位于第三周期,则C元素的半径最小,同周期元素从左到右元素的原子半径逐渐减小,则子半径由小到大的顺序为C<Cl<Si<Al,故A错误;
B、Z的最高价氧化物是二氧化硅,二氧化硅不与水反应,故B错误;
C、Al在高温下可以与氧化铁发生铝热反应,置换出铁,故C正确;
D、W的气态氢化物为HCl,溶于水形成盐酸,HCl是强电解质,在溶液中完全电离,室温下,0.1?mol/L?盐酸溶液的pH=1,故D错误.
故选C.
本题解析:
本题难度:简单