| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点大全《弱电解质电离平衡》高频考点强化练习(2020年最新版)(二)
参考答案:C 本题解析:根据方程式可知,要使指示剂显红色,则平衡应该向逆反应方向进行。所以根据方程式可知,增大氢离子浓度可以使平衡向逆反应方向进行,溶液显红色,答案选C。 本题难度:一般 3、选择题 在-50℃时,液氨的电离跟水的电离相似,存在平衡,2NH3(l)?N A.在液氨中加入NaNH2,可使液氨的离子积变大 B.在液氨中加入NH4Cl,液氨的离子积不变 C.此温度下液氨的离子积K为1×10-30 D.在液氨中加入金属钠可能有NaNH2生成 参考答案:A、虽然加入NaNH2可使平衡向逆反应方向移动,NH2-的浓度增大,但由水的离子积可知,其大小只与温度有关,与离子浓度无关,故A错误; 本题解析: 本题难度:简单 4、填空题 今有①CH3COOH;②HCl;③H2SO4三种溶液,选择填空: 参考答案:(1)A 本题解析: 本题难度:一般 5、选择题 下表是不同pH环境时某浓度铬酸(H2CrO4)溶液中,离子浓度(mol/L)与pH的关系,下列说法错误的是
A.铬酸第一级电离方程式为H2CrO4 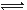 H++HCrO4— H++HCrO4—B.要得到CrO42—应控制溶液的pH>9? C.当电离达到平衡时,2v(正)(HCrO4—)= v(逆)(Cr2O72—) D.该铬酸溶液的物质的量浓度约为1.00mol/L? 参考答案:AC 本题解析:A由表中的数据在PH=4时,c(HCrO4—)= 0.1040可知:铬酸第一级电离方程式为H2CrO4 =H++HCrO4—。错误。B.由表中的数据可知:当PH=9时c(CrO42—)= 0.9960mol/L而c(HCrO4—)、c(Cr2O72—)很小很小。可?见要得到CrO42—应控制溶液的pH>9。正确。C.当电离达到平衡时, v(正)(HCrO4—)= 2v(逆)(Cr2O72—)。错误。D根据Cr守恒可确定c(H2CrO4)= c(CrO42—)+ c(HCrO4—)+2 c(Cr2O72—)= 0.9960+0.0031+0.0004×2=0.9999mol/L.因此该铬酸溶液的物质的量浓度约为1.00mol/L?。正确。2CrO4)溶液中,离子浓度与pH的关系的知识。 本题难度:一般 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学必考知识点《阿伏伽德罗.. | |