| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学试题《离子共存》考点巩固(2020年最新版)(四)
参考答案:D 本题解析:由于无色溶液与过量溴化氢反应生成了气体甲和淡黄色沉淀,沉淀若是溴化银,则不存在S2-、CO32-、SO32-,就不可能生成气体甲,所以淡黄色沉淀为单质硫,是硫化氢与二氧化硫反应生成的,溶液中一定存在硫离子和亚硫酸根离子,一定不会存在Ag+、Ba2+、Al3+,故A项错误;溶液甲中含有过量的溴化氢,与过量的碳酸氢铵反应,生成的气体乙为二氧化碳,白色沉淀只能为氢氧化铝,说明原溶液中一定含有偏铝酸根离子;溶液乙与过量氢氧化钡溶液反应,生成的气体丙为氨气,白色沉淀为碳酸钡或碳酸钡和硫酸钡,则B项错误;但不能确定是否含碳酸根,故气体甲可能为①SO2、②H2S、③CO2、④SO2和CO2、⑤H2S和CO2等五种情况,故C项错误;所以根据电荷守恒溶液中一定存在的离子有:Na+、S2-、SO32-、AlO2-; 一定不存在的离子为:Ag+、Ba2+、Al3+;可能存在的离子为:CO32-、SO42-,故D项正确;本题选D。 本题难度:困难 2、选择题 下列离子方程式正确的是 |
参考答案:C
本题解析:A.由于Na活动性很强,所以把Na会先与溶液中的水发生置换反应,错误;B.向FeCl3溶液中滴加KSCN溶液,发生离子反应Fe3+ + 3SCN- = Fe(SCN)3,产生的是可溶性弱电解质,不是沉淀,错误;C.向NaHCO3溶液中加过量Ca(OH)2溶液,不足量的NaHCO3完全反应,以NaHCO3为标准,离子方程式是:Ca2+ + HCO3- + OH- = CaCO3↓ + H2O,正确;D.向BaCO3固体中加入过量的稀H2SO4,产生的BaSO4是沉淀,离子方程式是:BaCO3 + 2H+ +SO42-= BaSO4+ CO2↑ + H2O,错误。
考点:考查离子方程式的正误判断的知识。
本题难度:一般
3、选择题 在溶液中能大量共存,加入OH-有沉淀析出,加入H+有气体放出的是( )
A.Na+、Cu2+、Cl-、SO42-
B.Fe3+、K+、SO42-、NO3-
C.H+、Al3+、OH-、NO3-
D.Na+、Ca2+、Cl-、HCO3-
参考答案:A.该组离子之间不反应,能共存,加OH-有氢氧化铜沉淀析出,但加入H+没有气体放出,故A不选;
B.该组离子之间不反应,能共存,加OH-有氢氧化铁沉淀析出,但加入H+没有气体放出,故B不选;
C.因H+、OH-结合生成水,Al3+、OH-结合生成沉淀,则不能共存,故C不选;
D.该组离子之间不反应,能共存,加OH-有碳酸钙沉淀析出,加入H+有二氧化碳气体,故D选;
故选D.
本题解析:
本题难度:简单
4、选择题 实验室需配制一种仅含四种离子(不包括水电离出的离子)的混合溶液,且在混合液中四种离子的物质的量浓度均为0.5 mol/L,下面四个选项中能达到此目的的是( )
A.Fe2+、Na+、NO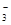 、Cl-
、Cl-
B.Mg2+、NH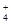 、SO
、SO 、NO
、NO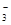
C.H+、K+、Cl-、CH3COO-
D.Fe3+、K+、AlO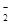 、SO
、SO
参考答案:B
本题解析:A、离子的物质的量浓度相等时 Fe2+、Na+、NO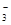 、Cl-不符合电荷守恒规律,错误;B、四种离子可以大量共存,且符合电荷守恒,正确;C、H+与CH3COO-反应生成醋酸,醋酸是弱电解质,不能大量共存,错误;D、Fe3+与AlO
、Cl-不符合电荷守恒规律,错误;B、四种离子可以大量共存,且符合电荷守恒,正确;C、H+与CH3COO-反应生成醋酸,醋酸是弱电解质,不能大量共存,错误;D、Fe3+与AlO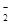 发生双水解反应不能大量共存且不符合电荷守恒,错误,答案选B。
发生双水解反应不能大量共存且不符合电荷守恒,错误,答案选B。
考点:考查离子的大量共存的判断
本题难度:一般
5、选择题 微粒的检验常用方法有三种:
| 检验方法 | 沉淀法 | 显色法 | 气体法 |
| 含义 | 反应中有沉淀产生或溶解 | 反应中有颜色变化 | 反应中有气体产生 |
 :气体法
:气体法 参考答案:D
本题解析:检验SO 的试剂是盐酸和氯化钡,属于沉淀法,D不正确,其余选项都是正确的,答案选D。
的试剂是盐酸和氯化钡,属于沉淀法,D不正确,其余选项都是正确的,答案选D。
考点:考查离子的检验
点评:该题是中等难度的试题,也是高考中的常见题型和考点,试题基础性强,侧重能力的培养。该类试题学生需要明确的是进行物质的检验时,要依据物质的特殊性质和特征反应,选择适当的试剂和方法,准确观察反应中的明显现象,如颜色的变化、沉淀的生成和溶解、气体的产生和气味、火焰的颜色等,进行判断、推理、验证即可。。
本题难度:简单
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学必考知识点《未知》高频.. | |