1、填空题 (10分)质量为34 g的NH3其物质的量是?mol,在标准状况下的体积约为?L 。0.1 mol H2S中有约?个氢原子;相同质量的NH3和H2S中分子个数比为?。配制100 mL浓度为1 mol·L-1的稀硫酸,需要用98%密度为1.84 g/cm3的浓硫酸?mL。
参考答案:2;? 44.8;? 1.204×1023;? 2:1;? 5.4(各2分,共10分)
本题解析:(1)根据n=m/M可知,34g氨气的物质的量是34g÷17g/mol=2mol;在标准状况下的体积是V=2mol×22.4L/mol=44.8L;根据H2S的化学式可知,1个H2S分子中含有2个氢原子,所以0.1molH2S分子中含有0.2mol氢原子,其个数是0.2mol×6.02×1023/mol=1.204×1023;氨气和H2S的相对分子质量分别是17和34,所以在质量相等的条件下,二者的分子数之比是1/17︰1、34=2︰1;在稀释过程中溶质的质量是不变的,所以需要浓硫酸的体积是 。
。
点评:在进行物质的量的有关计算时,关键是熟练应用几个关系式 、n=m/M、
、n=m/M、 、
、 ,特别还要注意气体摩尔体积的使用条件,即只能适用于气体,且只有在标准状况下,气体的摩尔体积才是22.4L/mol。例外还需要注意分子的个数和原子的个数是不同的,计算时需要分清楚。
,特别还要注意气体摩尔体积的使用条件,即只能适用于气体,且只有在标准状况下,气体的摩尔体积才是22.4L/mol。例外还需要注意分子的个数和原子的个数是不同的,计算时需要分清楚。
本题难度:一般
2、选择题 如果2g甲烷含有的分子数为a个,则22g二氧化碳的分子数为
A.a个
B.0.5a个
C.2a个
D.4a个
参考答案:D
本题解析:2g甲烷、22g二氧化碳分别为0.125mol、0.5mol,则二氧化碳的分子数为4a个。
本题难度:简单
3、计算题 欲将0.10 mol/L的NaOH溶液和0.60 mol/L的NaOH溶液混合成0.20 mol/L的NaOH溶液。求两种溶液的体积比(忽略混合时体积变化)。
参考答案:解:方法1(列方程法):设所需0. 10 mol/L的NaOH溶液及0. 60 mol/L的NaOH溶液的体积分别是V1和
V2,根据混合前后溶质的物质的量不变列式得:0.10mol/L×V1+0.60mol/L×V2= 0. 20 mol/L×(V1+V2)
解得: 方法2(十字交叉法):将以上方程式换种方式表述,将三个浓度十字交叉可得体积比。
方法2(十字交叉法):将以上方程式换种方式表述,将三个浓度十字交叉可得体积比。 

本题解析:
本题难度:一般
4、选择题 设NA为阿伏加德罗常数,下列叙述正确的是
A.27g铝的原子最外层电子总数为NA
B.2.8 g N2和2.8 g CO所含电子数均为1.4NA
C.1L0.1mol·L-1乙酸溶液中H+数为0.1NA
D.标准状况下,22.4L乙醇的分子数为NA
参考答案:B
本题解析:Al最外层电子数为3,1molAl最外层电子数为3mol,A错误;N2和CO是等电子体,B正确;乙酸是弱酸,部分电离,C错误;标准状况下,乙醇是液体,D错误。A
点评:有关NA的常见命题陷阱:温度和压强、物质的状态、单质的组成、粒子的数目、物质的结构、物质的变化等。
本题难度:一般
5、选择题 分别取两份a L含(NH4)2SO4和NH4NO3的混合液,一份用b mol NaOH并加热刚好把NH3全部赶出,另一份与BaCl2溶液完全反应,消耗c mol BaCl2。则原溶液中NO3-的物质的量浓度(单位mol·L-1)为
A.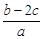
B.
C.
D.