1、填空题 25℃时,0.1mol·L-1 HA溶液pH=2,0.1mol·L-1 HB溶液pH=3。
(1)前 者大于后者的是 (多选、错选均不给分,下同);
者大于后者的是 (多选、错选均不给分,下同);
①HA、HB的电离平衡常数 ②HA、HB的电离度 ③溶液中的c(OH-)
④溶液的导电性 ⑤溶液中由水电离出的c(H+)
(2)若HA、HB溶液的pH相同、体积相等,前者小于后者的是 ;
①HA、HB物质的量浓度 ②同时加入足量的锌,开始反应时速率
③同时加入足量的锌,反应完全后生成H2的质量 ④二种酸溶液的导电能力
⑤用1mol/LNaOH溶液分别中和二种酸,消耗NaOH溶液体积
⑥将这两种溶液分别稀释10倍后溶液的pH。 (3)若中和体积为Va浓度为0.1mol·L-1 HA溶液,消耗0.1mol·L-1 NaOH溶液的体积为Vb,且Va>Vb,下列说法一定正确的是 。(提示:CH3COONa溶液呈碱性)
①混合后溶液呈中性 ②混合后溶液呈酸性  ③混合后溶液呈碱性
③混合后溶液呈碱性
④混合后溶液中的溶质为NaA ⑤混合后溶液中的溶质为NaA和HA
⑥混合后溶液中的溶质为NaA和NaOH
参考答案:(1) ①②④ (2) ①③⑤ (3) ⑤
本题解析:略
本题难度:一般
2、选择题 在恒温条件下,对0.1 mol/L的醋酸溶液进行稀释,在稀释过程中下列说法正确的是
[? ]
A.n(H+)增大
B.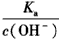 增大
增大
C.KW·c(CH3COO -)增大
D.c(H+)·c(OH -)减小
参考答案:A
本题解析:
本题难度:一般
3、填空题 (12分)
Ⅰ下列物质属于强电解质的是 (填序号)①BaCO3②浓硫酸③Al(OH)3④(NH4)2CO3⑤CH3COOH⑥C6H6⑦SO3⑧CsOH⑨H2S⑩Fe(OH)3
Ⅱ(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质中最理想的是
A. KMnO4 B. H2O2 C. Cl2水 D. HNO3
然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的
A. NaOH B. NH3·H2O C. CuO D. Cu(OH)2
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶1×10-5 mol·L-1度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为 ,Fe3+完全沉淀时溶液的pH为 ,通过计算确定上述方案 (填“可行”或“不可行”)
参考答案:Ⅰ①④⑧ Ⅱ(1)B CD (2)4 3.3 可行
本题解析:I强电解质包含强酸强健和大部分的盐,所以①④⑧属于强电解质。
II(1)Fe2+完全水解的pH为9.6,Fe3+完全水解的pH为3.2,所以要加氧化剂将Fe2+氧化成Fe3+除去,氧化时不能引入杂质,所以选择H2O2做氧化剂。调节溶液的pH时,为了不引入其他杂质,选择铜的碱性化合物,如CuO、Cu(OH)2、CuCO3等。
(2)Ksp[Cu(OH)2]=c(Cu2+) c(OH-)2,当溶液中c(Cu2+)="3.0" mol·L-1可求得c(OH-)=10-10mol/L,所以溶液的pH=4。Ksp[Fe(OH)3]=c(Fe3+) c(OH-)3,当溶液中c(Fe3+)=1×10-5 mol·L-1,可求得c(OH-)=2×10-11mol/L,所以pH为3.3,因此方案可行。
考点:沉淀溶解平衡
点评:要熟练掌握Ksp的计算方法。
本题难度:困难
4、选择题 下列事实中,不能证明醋酸是弱酸的是?(?)
A.醋酸能与大理石反应产生二氧化碳气体
B.pH = 3的醋酸溶液稀释100倍后pH<5
C.室温下,醋酸钠溶液的pH>7
D.常温下,0.1 mol·L-1醋酸溶液pH="2.5"
参考答案:A
本题解析:A.醋酸能与大理石反应产生二氧化碳气体,只能证明醋酸比碳酸的酸性强,并不能证明是弱酸。
B. pH = 3的醋酸溶液稀释100倍后如果是强酸,pH=5,现在是小于5,是弱酸
C.室温下,醋酸钠溶液的pH>7,强碱弱酸盐PH大于7,醋酸为弱酸
D.如果是强酸,常温下,0.1 mol·L-1醋酸溶液pH=1
本题难度:简单
5、选择题 在100mL0.1mol/L 的醋酸溶液中,欲使醋酸的电离度增大,H+ 浓度减小,可采用的方法是(?)?
A.加热
B.加入0.1mol/L 的醋酸溶液100mL
C.加入少量的0.5mol/L的硫酸
D.加入少量的1mol/L 的NaOH溶液
参考答案:D
本题解析:加入氢氧化钠,与醋酸电离出的H+反应,使其减少,促进醋酸的电离。
本题难度:简单