1、选择题 已知100℃时,0.01mol·L-1 NaHSO4溶液中水电离的c(H+)=10-10 mol·L-1,该温度下将pH=8的Ba(OH)2溶液V1 L与pH="5" V2 L NaHSO4混合,所得溶液pH=7,则 V1∶V2=
A.2∶9
B.1∶9
C.1∶1
D.1∶2
参考答案:A
本题解析:0.01mol·L-1 NaHSO4溶液中水电离的c(H+)=10-10 mol·L-1,说明溶液中OH-的浓度也是10-10 mol·L-1,氢离子浓度是0.01mol/L,所以该温度下水的离子积常数为1×10-12。所得溶液pH=7,说明溶液显碱性,即碱是过量的,所以有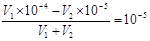 ,解得V1∶V2=2∶9,答案选A。
,解得V1∶V2=2∶9,答案选A。
本题难度:简单
2、选择题 下列物质不属于电解质,但与水反应的产物中既有强电解质又有弱电解质的是(? )?
A.NH3
B.Cl2
C.ICl
D.(CH3CO)2O
参考答案:BC
本题解析:本题进一步考查电解质的相关概念,并与具体的化学反应相结合,起到了区别电解质与非电解质、强电解质与弱电解质,单质与化合物与电解质之间的关系等易混淆的概念的作用。
本题难度:简单
3、选择题 下列比较中,正确的是
A.同温度同物质的量浓度时,HF比HCN易电离,则等浓度等体积的NaF溶液比 NaCN 溶液中阴子总数少
B.0.2 mol?L-l NH4Cl 和 0.l mol?L-l NaOH 溶液等体积混合后:c (Cl-) > c(NH4+)> c (Na+) > c (OH-) >c (H+)
C.0.1 mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
D.相同物质的量浓度的下列溶液中,①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、④NH3·H2O;c(NH4+) 由大到小的顺序是:①>②>④>③[来源:91考试网]
参考答案:B
本题解析:A、酸性:HF>HCN,故等浓度的NaF溶液中氟离子的水解程度比 NaCN 溶液中CN-的水解程度小,溶液的碱性弱,但二者水解均产生氢氧根,则等浓度等体积的NaF溶液和 NaCN 溶液中阴子总数相等,错误;B、0.2 mol?L-l NH4Cl 和 0.l mol?L-l NaOH 溶液等体积混合后所得溶液为等浓度的氯化铵、氯化钠和一水合氨的混合液,溶液呈碱性,一水合氨的电离程度大于铵离子的水解程度,离子浓度大小关系为:c (Cl-) > c(NH4+)> c (Na+) > c (OH-) >c (H+),正确;C、0.1 mol/L的NaHB溶液pH为4说明HB-的电离程度大于其水解程度,又电离和水解都是微弱的,则有:c(HB-) >c(B2-) >c(H2B),错误;D.氨水中的 NH4+来自弱电解质NH3·H2O的电离,弱电解质的电离的电离是微弱的,其余三者中NH4+来自强电解质盐的电离,铵离子的水解微弱,故相同物质的量浓度的四种溶液中, NH3·H2O中c(NH4+) 最小,错误。
考点:考查离子浓度大小比较。
本题难度:困难
4、选择题 氢离子浓度相同的等体积的两份溶液A和B;A为盐酸,B为醋酸,分别和锌反应,若最后仅有一份溶液中存在锌,且放出氢气的质量相同,则下列说法正确的是
[? ]
①反应所需要的时间B>A ②开始反应时的速率A>B
③参加反应的锌的物质的量A=B ④反应过程的平均速率B>A
⑤盐酸里有锌剩余 ⑥醋酸里有锌剩余
A.③④⑤
B.③④⑥
C.②③⑤
D.②③⑤⑥
参考答案:A
本题解析:
本题难度:一般
5、填空题 (9分)4种短周期元素相对位置如下表。M元素既是构成生物体的基本元素,又是构成地壳中岩石和化石燃料的主要元素。回答下列问题:
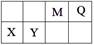
(1)X的原子结构示意图为 。
(2)0.1 molQ的10电子氢化物与CuO反应生成Cu2O、H2O和Q单质时,生成Cu2O的物质的量是 。
(3)Y的氧化物与NaOH溶液反应的化学方程式是 。
(4)HR是含M元素的一元酸。常温下,0.1 mol·L-1 HR 溶液中,c(H+) =1.3×10-3 mol·L-1。则HR H++R-的电离平衡常数Ka= (保留一位小数)。
H++R-的电离平衡常数Ka= (保留一位小数)。
参考答案:(9分)
(1)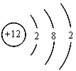 (2分) (2)0.15mol(2分)
(2分) (2)0.15mol(2分)
(3)Al2O3+2NaOH+3H2O=2Na[Al(OH)4](3分) (4)1.7×10-5(2分)
本题解析:M元素既是构成生物体的基本元素,又是构成地壳中岩石和化石燃料的主要元素,则M为C元素、Q为N元素、X为Mg元素、Y为Al元素。
(1)X为Mg元素,则X的原子结构示意图为: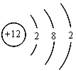
(2)Q的10电子氢化物为NH3,根据氧化还原反应中得失电子数相等可得对应关系:2NH3~3Cu2O,所以n(Cu2O)=3/2n(NH3)=3/2×0.1mol=0.15mol。
(3)Y的氧化物为Al2O3,属于两性氧化物,与NaOH溶液反应的化学方程式为:Al2O3+2NaOH+3H2O=2Na[Al(OH)4]。
(4)HR溶液中,H2O电离出的H+浓度非常小,可以忽略,所以HR电离平衡常数Ka=c(R-)?c(H+)/c(HR)= 1.3×10-3 ×1.3×10-3 /0.1=1.7×10-5。
考点:本题考查原子结构、元素周期律、氧化还原反应的计算、电离常数的计算。
本题难度:一般