1、选择题 将自来水加工成蒸馏水过程中,没有涉及到的过程或变化是
A.蒸发
B.冷凝
C.化学变化
D.物理变化
参考答案:C
本题解析:自来水变成蒸馏水属于物理变化,所以答案选C。
本题难度:简单
2、实验题 (8分)(1) 某实验室要用90mL1.00 mol·L-1的NaOH溶液。在配制该NaOH溶液的过程中:
①除了要使用托盘天平、药匙、烧杯、玻璃棒、胶头滴管,还要使用的仪器有?。
②需用托盘天平称取NaOH的质量为?g。
(2)从海带中提取碘的流程如下图:
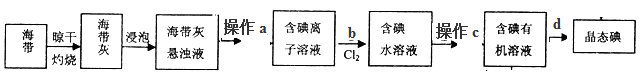 ?
?
①指出提取碘的过程中实验操作、操作的名称:a__________、c__________
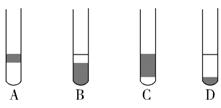
②在3mL碘水中,加入1mL四氯化碳,振荡、静置后,观察到试管里的分层现象是
?。(注:下图试管中深色区为紫红色溶液)
参考答案:(1)①100mL容量瓶;② 4.0g;(2)①过滤,萃取分液;② D。
本题解析:(1)①实验室要用90mL 1.00mol?L-1的NaOH溶液,需要配制100ml1.00mol?L-1的NaOH溶液;配制步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等,根据步骤确定仪器,需要的仪器为:托盘天平、药匙、烧杯、筒量、玻璃棒、胶头滴管和100mL容量瓶;②实验室要用90mL 1.00mol?L-1的NaOH溶液,需要配制100ml1.00mol?L-1的NaOH溶液,需用托盘天平称取NaOH的质量=0.100L×1.00mol?L-1×40g/mol=4.0g;(2)①根据题给流程图知,操作a为分离固体和液体混合物的操作,为过滤,操作c为利用溶质在互不相溶的溶剂里溶解度不同,用一种溶剂把溶质从它跟另一种溶剂所组成的溶液里提取出来,这种方法叫做萃取分液;②碘在四氯化碳中的溶解度大于在水中的溶解度,能将碘水中的碘转移到四氯化碳中,四氯化碳的密度比水大,溶解碘后溶液为紫红色,所以在3mL碘水中,加入1mL四氯化碳,振荡、静置后,观察到试管里的分层现象是溶液分层,上层颜色接近无色,下层呈紫红色;选D。
本题难度:一般
3、选择题 下列实验方案能达到目的是( )
A.除去Fe粉中混有的I2:加热使I2升华
B.除去NaCl固体中混有的MgCl2:加入KOH溶液后过滤,滤液蒸发结晶
C.除去碳酸钠中混有的碳酸氢钠:加入过量的氢氧化钠溶液,蒸发结晶
D.除去氢氧化镁中混有的氢氧化钙:放入水中搅拌成浆状后,加入足量氯化镁溶液,加适量水过滤洗涤
参考答案:D
本题解析:
本题难度:简单
4、选择题 广州地区的自来水是采用氯气消毒的,为了检验Cl-的存在,最好选用下列物质中的
A.石蕊溶液
B.四氯化碳
C.氢氧化钠溶液
D.硝酸银溶液
参考答案:D
本题解析:检验氯离子常用的试剂是硝酸银溶液,现象是产生不溶于水的白色沉淀,答案选D。
本题难度:简单
5、选择题 从含有Ag+、Fe3+和Al3+的溶液中,按如图所示方法分离提取金属单质.已知:实验时甲、乙、丙、丁四种物质只能从碳酸铵、氢氧化钠、稀硫酸、葡萄糖四种溶液中选择,也可用这四种溶液来制取.对该实验过程的分析正确的是( )
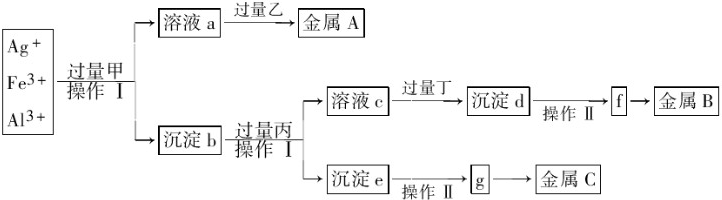
A.丙是NaOH,丁是稀H2SO4
B.乙是葡萄糖,利用乙的还原性将金属A从溶液a中还原出来
C.操作I是过滤和洗涤沉淀.洗涤沉淀的方法是将漏斗中的沉淀转移到小烧杯中,加蒸馏水浸没沉淀,用玻璃棒搅拌,然后将水倒出,重复2-3次
D.g是氧化物,金属c采用电解法获得
参考答案:在含有较多Ag+、Fe3+、Al3+的工业废水中加入甲(碳酸铵),Fe3+、Al3+会生成沉淀b(氢氧化铁和氢氧化铝),Ag+反应生成银氨溶液(溶液a),在银氨溶液中加入葡萄糖会生成金属A(银),沉淀b加入过量的氢氧化钠溶液,氢氧化铝会溶解,过滤后得到沉淀e(氢氧化铁)和溶液c(含偏铝酸钠);氢氧化铁灼烧得到g(氧化铁),氧化铁被还原得到金属C(铁);溶液c加入酸性物质生成氢氧化铝沉淀d,氢氧化铝受热分解得到f氧化铝,电解氧化铝可得金属B(铝).
A.丙是NaOH,丁是稀H2SO4,故A正确;
B.银氨溶液中加入葡萄糖会生成单质银,故B正确;
C.洗涤沉淀的方法是向漏斗中加蒸馏水浸没沉淀,待水自然流出后,重复2-3次,不能将沉淀转移到小烧杯中,也不能用玻璃棒搅拌,故C错误;
D.由g(氧化铁)得到金属C(铁)通常用热还原法制得,故D错误;
故选AB.
本题解析:
本题难度:一般