1、填空题 CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
沉淀物
| Fe(OH)3
| Fe(OH)2
| Co(OH)2
| Al(OH)3
| Mn(OH)2
|
开始沉淀
| 2.7
| 7.6
| 7.6
| 4.0
| 7.7
|
完全沉淀
| 3.7
| 9.6
| 9.2
| 5.2
| 9.8
|
?
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方程式________________________。
(2)写出NaClO3发生反应的主要离子方程式_____________________________;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式_______________。
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为?。
(4)“操作1”中包含3个基本实验操作,它们依次是_________、__________和过滤。制得的CoCl2·6H2O在烘干时需减压烘干的原因是__________________。
(5)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取剂的目的是_________;其使用的最佳pH范围是________________。
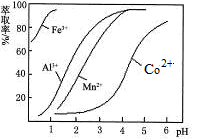
A.2.0~2.5?B.3.0~3.5?C.4.0~4.5?D.5.0~5.5
(6)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是_____________________。(答一条即可)
参考答案:(1)Co2O3+SO32-+4H+=2Co2++SO42-+2H2O?(2分)
(2)ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O?ClO3-+5Cl-+6H+=3Cl2↑+3H2O(每空2分)
(3)Fe(OH)3?Al(OH)3?(2分)
(4)蒸发(浓缩)、冷却(结晶) (2分)?降低烘干温度,防止产品分解(1分)
(5)除去溶液中的Mn2+?B?(每空1分)
(6)粗产品含有可溶性氯化物或晶体失去了部分结晶水?(1分)
本题解析:(1)向水钴矿[主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等]
加入盐酸和亚硫酸钠,浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等,所以Co2O3和亚硫酸钠在酸性条件下发生氧化还原,根据电荷守恒和得失电子守恒,反应为:Co2O3+SO32-+4H+=2Co2++SO42-+2H2O;
(2)加入NaClO3,会发生FeCl2中铁元素的化合价+2→+3,失去电子,NaClO3中氯元素的化合价由+5→-1价,得到电子,根据电荷守恒和得失电子守恒,反应为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O,“浸出液”中加过量NaClO3时,有毒气体是氯气,所以推断是NaClO3和“浸出液”中的氯离子发生了氧化还原反应,ClO3-中Cl元素的化合价由+5价降低为0价,HCl中Cl元素的化合价由-1价升高到0,根据电子守恒及质量守恒定律来配平,所以其方程式为:KClO3+6HCl=KCl+3Cl2↑+3H2O,离子方程式是ClO3-+5Cl-+6H+=3Cl2↑+3H2O;
(3)加Na2CO3调pH至5.2,铝离子能与碳酸根离子发生双水解生成氢氧化铝和二氧化碳,水解的离子方程式为:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑;铁离子能与碳酸根离子发生双水解生成氢氧化铁和二氧化碳,水解的离子方程式为:2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑;故答案为:Fe(OH)3、Al(OH)3;
(4)从溶液中制取固体的方法制取氯化钴固体,其操作步骤是蒸发浓缩、冷却结晶和过滤,根据题意知,CoCl2·6H2O常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴,为防止其分解,制得的CoCl2·6H2O需减压烘干;
(5)根据流程图可知,此时溶液中存在Mn2+、Co2+金属离子,由萃取剂对金属离子的萃取率与pH的关系可知
调节溶液PH在3.0~3.5之间,可使Mn2+完全沉淀,并防止Co2+转化为Co(OH)2沉淀,故答案为:除去溶液中的Mn2+;选B;?
(6)根据CoCl2·6H2O的组成分析,造成产品中CoCl2·6H2O的质量分数大于100%的原因可能是:含有杂质,导致氯离子含量大,结晶水化物失去部分水,导致相同质量的固体中氯离子含量变大。2·6H2O的工艺流程。
本题难度:困难
2、选择题 下图中所示的实验方法、装置或操作完全正确的是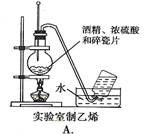
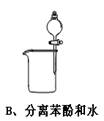

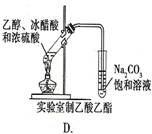
参考答案:B
本题解析:
正确答案:B
A、温度计水银球应在液面以下;B、正确;C、温度计水银球应在蒸馏烧瓶的支管口处;D、右侧的导管应在Na2CO3溶液的液面以上。
本题难度:一般
3、选择题 下列过滤操作中不正确的是
[? ]
A.滤纸应紧贴漏斗内壁并用少量水润湿,使滤纸与漏斗之间没有气泡
B.漏斗下端管口应紧靠承接烧杯内壁
C.倒入漏斗的过滤液的液面应高于滤纸边缘
D.要沿着玻璃棒慢慢向漏斗中倾倒过滤液
参考答案:C
本题解析:
本题难度:简单
4、简答题 将下列各种液体分别与溴水混合并振荡,不能发生化学反应,静置后混合液分成两层,溴水层几乎无色的是( )
A.酒精
B.己烯
C.苯
D.碘化钾溶液
参考答案:A、酒精和水互溶,所以不能萃取溴,所以溴水有颜色,故A错误;
B、己烯能和溴发生加成反应,故B错误;
C、苯和水不互溶且溴在苯中的溶解度大于水中的溶解度,苯和溴不反应,所以苯能萃取溴,使溴水层几乎无色,故C正确.
D、溴和碘化钾发生置换反应,故D错误.
故选C.
本题解析:
本题难度:一般
5、选择题 下列物质能用于萃取溴水中的溴的是
A.直馏汽油
B.裂化汽油
C.酒精
D.己烷
参考答案:AD
本题解析:直馏汽油的主要成分是液态烷烃或环烷烃,不溶于水,密度比水小,能将溴水中的溴萃取出来,因为溴在液态烷烃或环烷烃中的溶解度远大于水中,故A选项正确;裂化汽油含有长链烷烃裂化时生成的液态烯烃,液态烯烃与溴水中的溴容易发生加成反应,不能作萃取剂,故B选项错误;酒精就是乙醇,与水以任意比例混合,不能作溴水的萃取剂,故C选项错误;己烷属于液态烷烃,不溶于水,密度比水小,可以把溴水中的溴萃取出来,因为溴在己烷中的溶解度远远大于水中,故D选项正确。
本题难度:一般