1、选择题 某些补铁剂的成分中含有硫酸亚铁,长期放置会因氧化而变质。检验硫酸亚铁是否变质的试剂是
A.稀盐酸
B.KSCN溶液
C.氯水
D.铁粉
参考答案:B
本题解析:Fe2+被空气中的氧气氧化为Fe3+,Fe3+的检验方法是向待测液中滴加KSCN溶液,若变为血红色溶液,则证明含有Fe3+。反应的离子方程式为:Fe3++3SCN-=" Fe" (SCN)3.选项为B.3+的检验方法。
本题难度:简单
2、实验题 实验室中用含少量CO2杂质的CO来还原铁的氧化物FexOy并证明CO能够还原FexOy,且本身被氧化为CO2,实验所提供的各种仪器和药品如下:
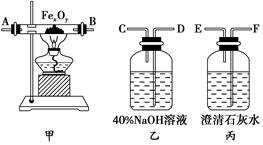
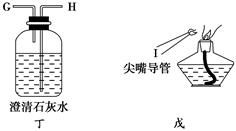
(1)实验时,上述仪器装置的正确连接顺序是(填写各接口的代号)。混合气体―→________,________接(F),(E)接________,________接________,________接________。
(2)在装置乙中发生反应的化学方程式是_______________________。
(3)在装置甲中发生反应的化学方程式是______________。
(4)丙装置中澄清石灰水的作用是_______________。
(5)经定量测定,0.4 g FexOy与CO反应生成的气体通入过量的澄清石灰水中,生成0.75 g白色沉淀,则FexOy中x值是________,y值是________。
(6)实验过程中,能说明CO能够还原FexOy的实验现象是___________。能够说明CO被氧化成CO2的实验现象是____________。
参考答案:(1)D C A B H G I
(2)2NaOH+CO2=Na2CO3+H2O
(3)FexOy+yCO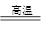 xFe+yCO2
xFe+yCO2
(4)检验CO2是否除净
(5)2 3
(6)固体粉末从红色变黑色 丁中澄清石灰水变浑浊
本题解析:据实验目的,分析每个装置的作用,然后连接;x、y值的计算依据C守恒关系CO~CO2~CaCO3
n(CaCO3)=n(CO)=0.75/100=7.5×10-3mol
FexOy中氧的质量为44 g·mol-1×7.5×10-3mol-28 g·mol-1×7.5×10-3mol=0.12 g
n(Fe)=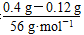 =0.005 mol,
=0.005 mol,
n(O)=0.12/16=0.007 5 mol,
x/y=2/3
本题难度:一般
3、填空题 铁黄是一种重要的颜料,化学式为Fe2O3·xH2 O,广泛用于涂料、橡胶、塑料、文教用品等工业。实验室模拟工业利用硫酸渣(含FeZ 0。及少量的CaO, Mg0等)和黄铁矿粉
(主要成分为FeS2)制备铁黄的流程如下:
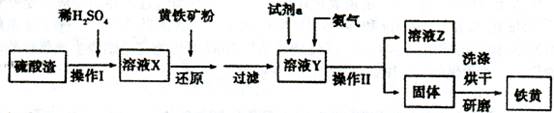
(1)操作I与操作II中都用到玻璃棒,玻璃棒在两种操作中的作用分别是_?、?
(2)试剂a最好选用_?(供选择使用的有:铝粉、空气、浓HNO3 );其作用是_?。
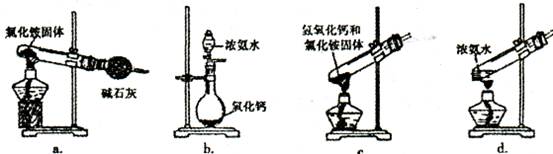
(3)上述步骤中需用到氨气。下列装置可用于实验室制氨气的是_?_(填序号)。
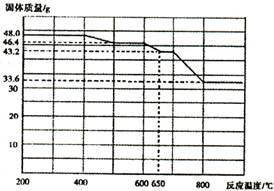
(4)查阅资料知,在不同温度下Fe2 O3被CO还原,产物可能为Fe3 O4?、FeO或Fe,固体质量与反应温度的关系如右图所示。根据图象推断670℃时Fe2 O3还原产物的化学式为M,并设计一个简单的实验,证明该还原产物的成分(依次填写每步操作中所加试剂的化学式、现象和结论)。仪器自选。可供选择的试剂:稀H2SO4、稀盐酸、H2 O2溶液、NaOH溶液、KSCN溶液。
?
参考答案:
(1)搅拌加速溶液;引流。(2)空气;作氧化剂,将二价铁离子氧化为三价铁离子;(3)bd; (4)
加入试剂
现象
结论
稀硫酸或稀盐酸
固体完全溶解且无气泡产生
则还原产物为FeO?
KSCN溶液
溶液不变色
H2O2溶液
溶液变为红色
本题解析:(1)操作I是搅拌加速溶液溶解,操作II是过滤操作,主要用到玻璃棒引流。(2)试剂a最好选用空气,来源廉价,其作用是作氧化剂,将二价铁离子氧化为三价铁离子。(3)实验室制氨气的主要是操作简单,制作方便,由于氨气易溶于水,故要加热,可选择bd。(4)对于二价铁离子有无可用KSCN溶液不显红色判断,对于有无固体铁可用加入酸有无气泡做出判断。CO还原氧化铁的还原产物为可能Fe3O4,FeO和Fe,Fe2O3加热温度可达到500℃~600℃,质量由46.4g减少为45g,还原产物为Fe3O4;650℃~700℃时,质量由43.2g减少较大,还原产物为FeO,为验证还原产物,在适量待检物中加入稀H2SO4至完全溶解,再加入少量高锰酸钾溶液,溶液紫色褪去,可说明还原产物为FeO,故答案为:Fe3O4;在适量待检物中加入稀H2SO4至完全溶解,再加入少量高锰酸钾溶液,溶液紫色褪去。
加入试剂
现象
结论
稀硫酸或稀盐酸
固体完全溶解且无气泡产生
则还原产物为FeO?
KSCN溶液
溶液不变色
H2O2溶液
溶液变为红色
考点:
本题难度:困难
4、计算题 现有铁和铜组成的合金共a mol,其中铜的物质的量分数为x。将此合金研成粉末状后全部投入含b mol硝酸的稀溶液中,微热使其充分反应,硝酸的还原产物只有NO。
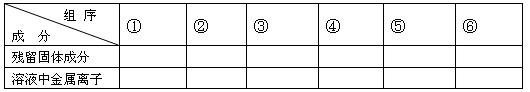
(1)用粒子符号填写下列空白(列举出全部可能出现的情况):
(2)当溶液中金属离子只有Fe2+、Cu2+时,则b的取值范围为(用a、x表示)
(3)当x=0.5时,溶液中Fe3+和 Fe2+的物质的量相等,在标准状况下共生成672毫升NO气体,求a和b的值。
参考答案:(1)
?组序
成?分
①
②
③
④
⑤
⑥
残留固体成分
Fe、Cu
Cu
Cu
无
无
无
溶液 中金属离子
中金属离子
Fe2+
Fe2+
Fe2+[来]
Cu2+
Fe2+
Cu2+
Fe2+、Cu2+Fe3+
Fe3+
Cu2+m]
本题解析:略
本题难度:一般
5、选择题 铁是一种应用广泛的金属。下列有关铁的说法正确的是
A.铁与盐酸反应生成氯化铁和氢气
B.常温下铁在浓硫酸中钝化
C.铁在氧气中燃烧生成物为三氧化二铁
D.纯铁(块状)是黑色金属
参考答案:B
本题解析:.铁与盐酸反应生成氯化亚铁和氢气,A不正确;B正确,C不正确,铁在氧气中燃烧生成四氧化三铁。纯铁是银白色金属,D不正确,答案选B。
点评:该题是识记性知识的考查,难度不大。平时注意知识的积累和总结,并能灵活运用即可,有利于巩固基础,通过学生的应试能力。
本题难度:一般