1、填空题 下表是元素周期表主族元素的一部分,短周期元素X的最高正化合价是+5,Y的单质
可在空气中燃烧。
?
请回答下列问题:
(1)Z的元素符号是?,写出Z的原子结构示意图:?。
(2)W的最高价氧化物不溶于水,但能溶于烧碱溶液,该反应的离子方程式为?。
(3)探究同主族元素性质的一些共同规律,是学习化学的重要方法之一。在下表中列出对H2ZO3各种不同化学性质的推测,举例并写出相应的化学方程式(化学方程式中Z用元素符号表示)
编号
| 性质推测
| 化学方程式
|
示例
| 氧化性
| H2ZO3+4HI=Z↓+2I2+3H2O
|
1
| ?
| ?
|
2
| ?
| ?
|
?
(4)由C、O和Y三种元素组成的化合物COY中,所有原子的最外层都满足8电子结构。写出该化合物的电子式:?。
参考答案:(1)Se?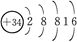
(2)SiO2+2OH-=SiO32-+H2O
(3)
1
还原性
2H2SeO3+O2=2H2SeO4(或Br2+H2SeO3+H2O=H2SeO4+2HBr等合理答案)
2
酸性
H2SeO3+2NaOH=Na2SeO3+2H2O(或其他合理答案)
?
(4) 
本题解析:易推出W、X、Y、Z分别是Si、P、S、Se。
(1)Se比S原子核外多18个电子,根据S的原子结构示意图即可写出Se的原子结构示意图。
(3)H2SeO3与H2SO3相似,具有氧化性、还原性和酸性。
本题难度:一般
2、填空题 元素周期表是学习和研究化学的重要工具。下列是元素周期表的部分信息:
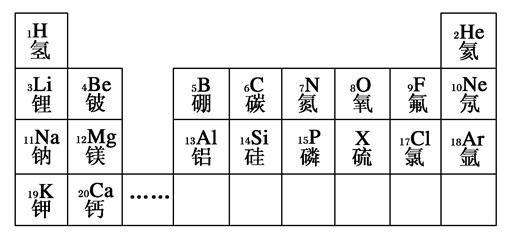
(1)地壳中含量最多的金属元素的原子序数是________。
(2)分析上表规律,可推知,表中X为________。
(3) 表示的是(写粒子符号)________。
表示的是(写粒子符号)________。
(4)写出一个由1、7、17号三种元素组成的化合物的化学式:________________________________________________________________________。
参考答案:(1)13?(2)16S?(3)K+?(4)NH4Cl
本题解析:(1)地壳中含量最多的金属元素是Al,其原子序数为13;
(2)由元素周期表中规律可推知X应为16S;
(3)19号元素为K,核外电子数比核电荷数少1,为K+;
(4)1号元素为H,7号元素为N,17号元素为Cl,组成的常见化合物为NH4Cl。
本题难度:一般
3、填空题 (8分)【化学-物质结构与性质】
硼元素在化学中有很重要的地位,硼及其化合物广泛应用于永磁材料、超导材料、富燃料材料、复合材料等高新材料领域应用。

(1)三氟化硼在常温常压下为具有刺鼻恶臭和强刺激性的无色有毒腐蚀性气体,其分子的立体构型为?,B原子的杂化类型为?。
(2)磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层。下图示意的是磷化硼的晶体结构单元,则磷化硼的化学式为?,微粒间存在的作用力为?。
(3)正硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子间通过氢键相连(如下图)。

①硼酸分子中B最外层有?个电子,1 mol H3BO3的晶体中有??mol氢键。
②硼酸溶于水应生成弱电解质一水合硼酸H2OB(OH)3,它电离生成少量[B(OH)4]-和的H+离子。则硼酸为?元酸, [B(OH)4]-含有的化学键类型为?。
参考答案:⑴平面三角形(1分)? sp2(1分)?⑵⑵Bp(1分)?共价键(1分)
⑶①6(1分)? 3(1分)?②一(1分)?共价键、配位键(1分)
本题解析:⑴BF3中B原子没有孤对电子,所以为平面三角形结构,因此B为sp2杂化。
⑵根据晶胞结构图,该晶胞中含有4个P,B原子的个数为8×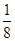 +6×
+6×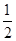 =4,因此化学式为BP。根据BP的性质及用途:耐磨涂料,可用作金属的表面保护层等可判断BP为原子晶体,微粒间作用力为共价键。
=4,因此化学式为BP。根据BP的性质及用途:耐磨涂料,可用作金属的表面保护层等可判断BP为原子晶体,微粒间作用力为共价键。
⑶①硼酸分子中B与三个原子形成单键,最外层有6个电子,根据图示,1个H3BO3分子与其他3个分子能形成6个氢键,因此1 mol H3BO3的晶体中氢键为6 mol×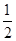 =3 mol。
=3 mol。
②硼酸溶于水,B原子与水电离出的OH-结合,产生H+,为一元酸,OH-中的O原子提供孤对电子,和B原子形成配位键。
本题难度:一般
4、选择题 有五瓶失去标签的溶液,它们分别为:①Ba(NO3)2 ②KCl ③NaOH ④CuSO4 ⑤Na2SO4 ,如果不用其他任何试剂(包括试纸),用最简便的方法将它们一一鉴别开来,则在下列的鉴别顺序中,最合理的是( ?)
A.③④①⑤②
B.④②③⑤①
C.①⑤③④②
D.④③①⑤②
参考答案:D
本题解析:试题分析:首先根据颜色鉴别出硫酸铜溶液,用硫酸铜溶液检出硝酸钡溶液、氢氧化钠溶液,用硝酸钡溶液检出硫酸钠溶液。
考点:物质的鉴别
点评:不用试剂鉴别的试题一般先观察试剂有无特殊颜色,再用它检出其它试剂,依此类推;若待检试剂均无色,两两混合观察现象。
本题难度:简单
5、选择题 下列关于氧族元素叙述错误的是
A.都能同氢气化合生成气态氢化物,其水溶液都显酸性
B.能跟大多数金属直接化合
C.原子的最外层都有6个电子,且彼此性质相似
D.单质的熔沸点及密度随核电荷数的增大而升高
参考答案:A
本题解析:氧族元素中单质碲不能与氢气直接化合,且H2O呈中性,其余为酸性。
本题难度:一般