1、选择题 W、X、Y、Z是短周期元素,其部分性质如下表
W
| 单质是淡黄色固体
|
X
| 在地壳中的含量居第二位
|
Y
| 原子最外层电子数是电子总数的2/3
|
Z
| 第三周期原子半径最小的金属
|
?
下列说法正确的是
A.气态氢化物的热稳定性:X>W
B.最高价氧化物对应水化物的酸性:Y>X
C.离子半径:Z>W
D.Z的氧化物中含有非极性共价键
参考答案:B
本题解析:W单质是淡黄色固体,则W为S元素;X在地壳中的含量居第二位,则X为Si元素;Y原子最外层电子数是电子总数的2/3,则与、Y为C元素;Z是第三周期原子半径最小的金属,则Z为Al元素。A、因为S的非金属性大于Si,所以气态氢化物的热稳定性:X< W,错误;B、因为S的非金属性大于Si,所以最高价氧化物对应水化物的酸性:Y>X,正确;C、Al3+为10电子离子,S2?为18e?微粒,所以离子半径:Z< W,错误;D、Z的氧化物为Al2O3,只含离子键,不含共价键,错误。
本题难度:一般
2、选择题 若某原子在处于能量最低状态时,外围电子排布为4d15s2,则下列说法正确的是
A.该元素原子最外层共有3个电子
B.该元素位于第5周期ⅡA族
C.该元素原子核外第N层上共有9个不同状态的电子
D.该元素原子第四电子层上有5个空轨道
参考答案:C
本题解析:A项:该元素原子最外层共有2个电子,故错;B项:该元素位于第五周期ⅢB族,故错;D项:4d15s2,第四层的d 亚层排1个电子,第五层的s亚层排两个电子,故错。故选C。
点评:元素原子的外围电子排布重复出现从ns1到ns2np6的周期性变化最外层不超过8个电子,次外层不超过18个电子;第n层最多排2n2个电子。
本题难度:一般
3、填空题 (18分)在第3周期中,置换酸中氢的能力最强的元素的元素符号为?,化学性质最稳定的元素符号是?,最高价氧化物的水化物的酸性最强的化合物的化学式是?,碱性最强的化合物的化学式是?,显两性的氢氧化物的化学式是?,该两性氢氧化物与盐酸、氢氧钠溶液分别反应的离子方程式为?、?,原子半径最大的金属元素的名称是?,离子半径最小的离子结构示意图是?。
参考答案:Na? Ar? HClO4? NaOH?Al(OH)3?Al(OH)3 +3H+ =Al3+ +3H2O
Al(OH)3 +OH― =AlO2-+2H2O?钠?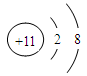
本题解析:同周期元素从左到右元素的金属性逐渐减弱,非金属性逐渐增强,以此判断对应的单质、化合物的相关性质。
本题难度:一般
4、选择题 镭是元素周期表中第7周期第ⅡA族元素,关于其叙述不正确的是( )。
A.镭的金属性比钙弱
B.单质能与水反应生成H2
C.镭在化合物中呈+2价
D.碳酸镭难溶于水
参考答案:A
本题解析:镭是第ⅡA族元素,自上至下,元素的金属性增强,故比钙还活泼,与水反应生成氢气,A错误,B正确;最外层有2个电子,在化合物中呈+2价,类比碳酸钙难溶于水,碳酸镭也难溶于水,C、D正确。
本题难度:一般
5、选择题 短周期主族元素W、X、Y、Z的原子序数依次增大,W、X原子的最外层电子数之比为4:3,Z原子比X原子的核外电子数多4。下列说法正确的是( )
A.W、Y、Z的电负性大小顺序一定是Z>Y>W
B.W、X、Y、Z的原子半径大小顺序可能是W>X>Y>Z
C.Y、Z形成的分子的空间构型可能是正四面体
D.WY2分子中σ键与π键的数目之比是2:1
参考答案:C
本题解析:根据所给信息和原子的结构推断出具体的元素,然后根据具体的元素及其化合物性质进行解答。
因为原子的最外层电子数不超过8个,且W、X为主族元素,故W、X的最外层电子数分别为4和3;结合Z的电子数比X多4且W、X、Y、Z原子序数依次增大可知,W为C元素,则X为Al元素,Z为Cl元素,Y为Si、P、S三种元素中的一种。A.若Y为Si元素,则电负性Cl>C>Si。B.因为C元素在第二周期,其余三种元素在第三周期,故原子半径X>Y>Z>W。C.若Y为Si元素,SiCl4的空间构型为正四面体。D.CS2分子的结构式为S=C=S,一个分子中含有两个σ键和两个π键。
点拨:知识:元素推断、元素电负性、原子半径、分子空间结构、共价键类型。能力:考查考生逻辑推理能力以及分析解决问题的能力。试题难度:中等。
本题难度:一般