1、选择题
在密闭容器中进行反应CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0,测得c(CH4)随反应时间(t)的变化如图所示.下列判断正确的是( )

A.10?min时,改变的外界条件可能是减小压强
B.0~5?min内,v(H2)=0.1?mol/(L?min)
C.恒温下,缩小容器体积,平衡后c(H2)减小
D.12?min时,反应达平衡时,气体的平均摩尔质量不再变化
参考答案:D
本题解析:
本题难度:一般
2、选择题 T℃时,在2L密闭容器中X(g)与Y(g)反应生成Z(g),浓度变化如图1所示;若其他条件不变,温度为T1和T2时Y的体积百分含量与时间关系如图2所示.下列结论正确的是( )
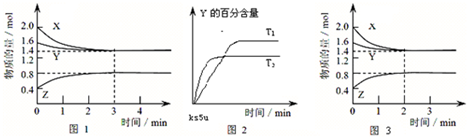
A.容器中的反应可表示为:3X(g)+Y(g)?2Z(g)
B.图1中,前3?min内X的反应速率为?v(X)=0.3mol/(L?min)
C.若其他条件不变,升高温度时反应的平衡常数K值变大
D.若改变条件,反应进程如图3所示,则改变的条件是增大体系的压强
参考答案:A、由图1知,X的物质的量减少量=(2.0-1.4)mol=0.6mol;Y的物质的量减少量=(1.6-1.4)mol=0.2mol;Z的物质的量增加量=(0.8-0.4)mol=0.4mol,同一化学反应同一时间段内,反应物减少的物质的量和生成物增加的物质的量之比等于其计量数之比,所以X、Y、Z的计量数之比=0.6mol:0.2mol:0.4mol=3:1:2,所以反应可表示为:3X(g)+Y(g)?2Z(g),故A正确.
B、v=△nV△t=(2.0-1.4)mol2L×3min=0.1mol/L.min,故B错误.
C、由图2知,“先拐平数值大”,所以T2>T1,升高温度Y的含量减少,平衡向正反应方向移动,即生成物的浓度增大反应物的浓度减少,所以平衡常数增大,故C正确.
D、由图1和图3知,反应物和生成物的变化量不变,但反应时间减小,说明改变的条件不影响化学平衡只影响反应速率,且该反应是一个反应前后气体体积减小的反应,所以只能是使用催化剂,故D错误.
故选AC.
本题解析:
本题难度:简单
3、填空题 Ⅰ某温度时,在2L密闭容器中某一反应的A、B物质的量随时间变化的曲线如图1所示,由图中数据分析求:
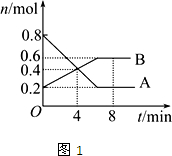
(1)该反应的化学方程式为______.
(2)反应开始至4min时,A的平均反应速率为______.
(3)第4min末时A、B的物质的量浓度依次为______、______.
第4min时,正、逆反应速率的大小关系为:v(正)______v(逆)(填“>”、“<”或“=”,同),第8min时,v(正)______v(逆).
Ⅱ有铜片、锌片和250mL稀硫酸组成的原电池,当在铜片上放出4.48L(标准状况下)的气体时,硫酸恰好完全反应.
(1)该原电池的正极反应式______
(2)原稀硫酸的物质的量浓度是______mol/L
(3)锌片减少的质量______g.
参考答案:Ⅰ.(1)由图可知,A减少,B增加,则A为反应物,B为生成物,相同时间内△n之比等于化学计量数之比,等于(0.8-0.2):(0.6-0.2)=3:2,所以该反应为3A 2B,故答案为:3A
2B,故答案为:3A 2B;
2B;
(2)反应开始至4min时,A减少0.8mol-0.4mol=0.4mol,v=△c△t=0.4mol2L4min=0.05mol/(L?min),故答案为:0.05mol/(L?min);
(3)4min末时A、B的物质的量均为0.4mol,c(A)=c(B)=0.4mol2L=0.2mol/L,第4min时向正反应方向进行,所以v(正)>v(逆),第8min时反应达到平衡,所以v(正)=v(逆),故答案为:0.2mol/L;0.2mol/L;>;=;
Ⅱ.(1)正极上氢离子得到电子,正极反应为2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
(2)铜片上放出4.48L,n(H2)=n(H2SO4)=4.48L22.4L/mol=0.2mol,c=nV=0.2mol0.25L=0.8mol/L,故答案为:0.8;
(3)由Zn~H2↑可知,溶解的Zn为0.2mol×65g/mol=13g,故答案为:13.
本题解析:
本题难度:一般
4、选择题 已知NO2和N2O4可以相互转化:2NO2(g)

N2O4(g);Q>0现将一定量NO2和N2O4的混合气体通入体积为1L的恒温密闭容器中,反应物浓度随时间变化关系如图.下列说法正确的是( )
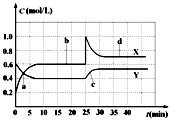
A.图中共有两条曲线X和Y,其中曲线y表示NO2浓度随时间的变化
B.a、b、c、d四个点中,表示化学反应处于平衡状态的点是b和c
C.反应进行至25min时,曲线发生变化的原因是加入0.4molN2O4
D.若要达到与d相同的状态,在25min时还能采取的措施是适当缩小容器体积
参考答案:D
本题解析:
本题难度:一般
5、选择题 可逆反应2A(g)+B(g)?2C(g),根据下表中的数据判断下列图象错误的是( )
| 压强A转化率温度 | p1(MPa) | p2(MPa)
400℃
99.6
99.7
500℃
96.9
97.8
|
A.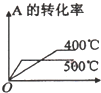
B.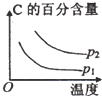
C.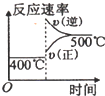
D.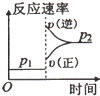
参考答案:由表中数据可知,在相同压强下,升高温度,A的转化率降低,说明升高温度平衡向逆反应方向移动,则正反应为放热反应,在相同温度下,增大压强,A的转化率增大,说明平衡向正反应方向移动,则
A.升高温度,A的转化率降低,与表中数据吻合,故A正确;
B.升高温度,平衡向逆反应方向移动,C的百分含量降低,增大压强,平衡向正反应方向移动,C的百分含量增大,与表中数据吻合,故B正确;
C.升高,反应速率增大,平衡向逆反应方向移动,逆反应速率大于正反应速率,与表中数据吻合,故C正确;
D.增大压强,反应速率增大,正反应速率大于逆反应速率平衡向正反应方向移动,图象与表中数据不吻合,故D错误.
故选D.
本题解析:
本题难度:简单