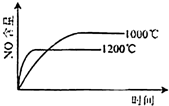
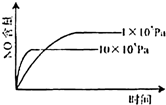
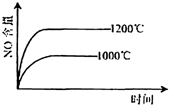
1、选择题 已知:4NH3(g)+5O2(g)=4NO(g)+6H2O(g),△H=-1025kJ/mol,该反应是一个可逆反应,若反应物起始的物质的量相同,下列关于该反应的示意图不正确的是( )
A.
B.
C.
D.
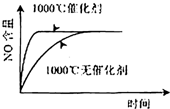
参考答案:C
本题解析:
本题难度:一般
2、填空题 “84”消毒液是一种以次氯酸钠(NaClO)为主的高效消毒剂和漂白剂,被广泛用于医院、宾馆、家庭等的卫生消毒.回答有关问题.
(1)“84”消毒液显碱性,原因是发生水解反应:ClO-+H2O?HClO+OH-.
①该反应的平衡常数表达式K=______;25℃时某“84”消毒液pH为10,35℃时pH为11,则温度升高,K______(填“增大”、“不变”或“减小”).
②测定“84”消毒液的pH,应该选用______.
A.干燥的pH试纸?B.用蒸馏水湿润的pH试纸?C.pH计(或酸度计)
(2)在烧杯中盛放25mL某浓度的“84”消毒液,在光照下对其消毒效果的变化进行探究,实验结果如图1所示.
①a-b段导致消毒效果增大的主要反应是:______.
②b-c段导致消毒效果减弱的主要反应是:______.
(3)有一则报道称:有人在清洗卫生间时,因为把“84”消毒液和某清洁剂(含盐酸)混合使用,发生了中毒事故.原因是______.
(4)利用图2所示装置和试剂可以制得少量“84”消毒液.
①a电极的名称是______.②y电极的反应式为______.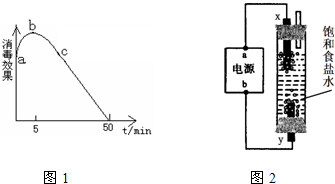
参考答案:(1)①水解平衡常数表达式K=c(HClO)?c(OH-)c(ClO-)?;升高温度,PH增大,氢氧根离子的浓度增大,次氯酸的浓度增大,次氯酸根离子的浓度减小,所以K增大,
故答案为:c(HClO)?c(OH-)c(ClO-)?;增大;
②“84”消毒液具有漂白性,能使有色物质褪色.
A、“84”消毒液具有漂白性,能使干燥的pH试纸褪色,故A错误;
B、“84”消毒液具有漂白性,能使用蒸馏水湿润的pH试纸褪色,故B错误;
C、“84”消毒液不改变pH计(或酸度计),故C正确;
故选C;
(2)①次氯酸是比碳酸还弱的酸,次氯酸钠和二氧化碳、水反应生成次氯酸和碳酸钠2ClO-+CO2+H2O=2HClO+CO32-,增大了次氯酸的浓度而使消毒效果增大,
故答案为:2ClO-+CO2+H2O=2HClO+CO32-;
②次氯酸不稳定,在光照下能分解生成氯化氢和氧气2HClO??光照?.?2HCl+O2↑,降低次氯酸的浓度,所以消毒效果降低,
故答案为:2HClO??光照?.?2HCl+O2↑;
(3)次氯酸钠具有强氧化性,盐酸有还原性,次氯酸钠能和盐酸发生氧化还原反应生成氯气,氯气有毒,所以把“84”消毒液和某清洁剂(含盐酸)混合使用会发生中毒事故,
故答案为:NaClO和HCl反应生成Cl2或ClO-+Cl-+2H+=Cl2↑+H2O;
(4)①由图2知,装置和试剂可以制得少量“84”消毒液,如果是x电极产生氯气,氯气会从导管口导出,从而得不到消毒液,所以只能是y电极产生氯气,即y电极为阳极,x电极为阴极,所以a为负极,b为正极,故答案为:负极;
②y为阳极,阳极上失电子发生氧化反应,溶液中氯离子的放电能力大于氢氧根离子的放电能力,所以氯离子在阳极上放电生成氯气,电极反应式为2Cl--2e-=Cl2↑,
故答案为:2Cl--2e-=Cl2↑.
本题解析:
本题难度:一般
3、填空题
|
工业上合成氨是在一定条件下进行如下反应:N2(g)+3H2(g)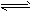 2NH3(g),△H=-92.2kJ/mol;其部分工艺流程如下
2NH3(g),△H=-92.2kJ/mol;其部分工艺流程如下

|
反应体系中各组分的部分性质见下表
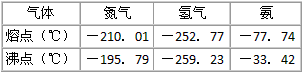
回答下列问题:
(1)写出该反应的化学平衡常数表达式:K=___________。随着温度升高,K值___________(填增大、减小、不变)。
(2)平衡常数K值越大,表明___________(填序号)。
A.N2的转化率越高
B.NH3的产率越大
C.原料中N2的含量越高
D.化学反应速率越快
(3)合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程。即反应后通过把混合气体的温度降低到___________使___________分离出来;继续循环的气体是___________。
参考答案:(1)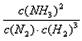 ;减小
;减小
(2)AB
(3)-33.42℃;氨;N2、H2
本题解析:
本题难度:一般
4、填空题 Ⅰ.描述弱电解质电离情况可以用电离度(电离度:一定条件下,当弱电解质达到电离平衡时,溶液中已电离的电解质分子数占原电解质分子总数的百分数)和电离平衡常数表示,下表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb),表2是常温下几种难(微)溶物的溶度积常数(Ksp)。
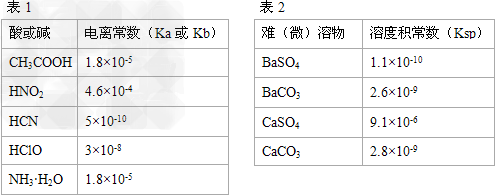
请回答下面问题:
⑴下列能使醋酸溶液中CH3COOH的电离度增大,而电离常数不变的操作是_______(填序号)。
A.升高温度?B.加水稀释? C.加少量的CH3COONa固体?D.加少量冰醋酸
⑵CH3COONH4的水溶液呈______(选填“酸性”、“中性”、“碱性”),理由是____________________。
⑶工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如:BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量的BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使c(SO42-?)达到0.0l?mol/L以上,则溶液中c(CO32-?)应≥_______?mol/L。
Ⅱ.化学在能源开发与利用中起着重要的作用,如甲醇、乙醇、二甲醚(CH3OCH3)等都是新型燃料。
⑴乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇。
2CO2(g)+6H2(g)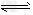 CH3CH2OH(g)+3H2O(g)?△H=a?kJ/mol 在一定压强下,测得上述反应的实验数据如下表。
CH3CH2OH(g)+3H2O(g)?△H=a?kJ/mol 在一定压强下,测得上述反应的实验数据如下表。
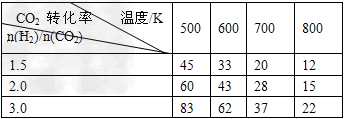
根据表中数据分析:
①上述反应的?a_______0(填“大于”或“小于”)。
②在一定温度下,提高氢碳(即n(H2)/n(CO2)?)比,平衡常数K值_______(填“增大”、“减小”、或“不变”),对生成乙醇______(填“有利”或“不利”)。
⑵催化剂存在的条件下,在固定容积的密闭容器中投入一定量的CO和H2,同样可制得乙醇(可逆反应)。该反应过程中能量变化如图所示:
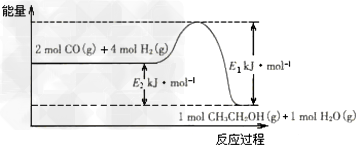
①写出CO和H2制备乙醇的热化学反应方程式_________________。
②在一定温度下,向上述密闭容器中加入1?mol?CO、3?mol?H2及固体催化剂,使之反应。平衡时,反应产生的热量为Q?kJ,若温度不变的条件下,向上述密闭容器中加入4?mol?CO、
12?mol?H2及固体催化剂,平衡时,反应产生的热量为w?kJ,则w的范围为___________。
⑶二甲醚(CH3OCH3)被称为21世纪的新型燃料,具有清洁、高效的优良性能。以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池,其工作原理与甲烷燃料电池原理相类似。该电池中负极上的电极反应式是_________________。
参考答案:Ⅰ⑴B;⑵中性;水电离出的H+和OH-的浓度相等,CH3COONH4溶于水后,根据电离平衡常数,CH3COO-结合H+和NH4+结合OH-生成弱电解质的程度一样,导致水溶液中的H+和
OH-浓度相等,呈中性;⑶0.24
Ⅱ⑴①小于;②不变;有利
?⑵①2CO(g)+4H2(g) CH3CH2OH(g)+H2O(g)? △H=-E2 kJ·mol-1;?②4Q<w<2E2
CH3CH2OH(g)+H2O(g)? △H=-E2 kJ·mol-1;?②4Q<w<2E2
⑶CH3OCH3-12e-+16OH-=2CO32-+ 11H2O
本题解析:
本题难度:困难
5、简答题 对于A(g)+B(g)?xC(g)△H?有:
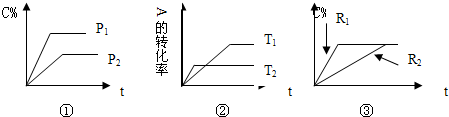
(1)①图表明P1______P2,且x的值为______
(2)②图表明T1______T2,且△H______0;
(3)如果③图R1,R2分别表示改变压强,则R1______R2,x的值为______;
(4)如果③图分别表示有无催化剂,则R1表示______催化剂.
参考答案:(1)由图可知,压强P1先到达平衡,故压强P1>P2,压强越大平衡时C%越大,增大压强平衡向正反应移动,故x<2
,故x=1,
故答案为:>,1;
(2)由图可知,温度T2先到达平衡,故温度T1<T2,温度越大平衡时A的转化率越小,升高温度平衡向逆反应移动,正反应为放热反应,即△H<0,
故答案为:<,<;
(3)压强越大,反应速率加快,到达平衡时间短,压强R1先到达平衡,故R1>R2,平衡不移动,反应前后气体的物质的量不变,即x=1+1=2,
故答案为:>,2;
(4)使用催化剂,反应加快,到达平衡的时间短,R1先到达平衡,R1表示有催化剂,
故答案为:有.
本题解析:
本题难度:一般