1、选择题 下列各组内的两种元素,在金属性或非金属性方面最有相似性的是
A.铝和氯
B.钠和氢
C.镁和氧
D.钾和氟
参考答案:A
本题解析:钠、镁和钾都是典型的金属元素,氢、氧、氟和氯都是典型的非金属元素,铝元素既有金属性又有非金属性,故答案为A.
本题难度:一般
2、简答题 下表标出的是元素周期表的一部分元素,回答下列问题
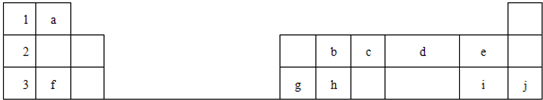
(1)表中列出的10种元素中,化学性质最不活泼的是______(填元素名称,下同),非金属性最强的是______,原子半径最小的是______.
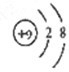
(2)分子bd2的电子式______,元素e的负一价阴离子的结构示意图______.
(3)物质bd2和hd2在物理性质上有着巨大差异,其原因是物质bd2属于______晶体,物质hd2属于______晶体.
(4)元素e的气态氢化物比元素i的气态氢化物______(填“稳定”或“不稳定”)
(5)元素f、g的最高价氧化物对应水化物之间反应的离子方程式是______;
(6)物质fda含有的化学键类型是______.
参考答案:根据元素在周期表中的分布知识,可以确定a是H,b是C,c是N,d是O,e是F,f是Na,g是Al,h是Si,i是Cl,j是Ar.
(1)表中列出的10种元素中,稀有气体元素Ar化学性质稳定,同一周期,元素原子半径从左到右半径在减小,同一主族元素的原子半径从上到下逐渐增大;所以原子半径最小的是H,同周期元素的原子从左到右,元素的非金属性逐渐增强,同一主族,元素的原子从上到下,元素的非金属性逐渐减弱,所以费金属性最强的是F,故答案为:氩;氟;氢;
(2)二氧化碳是碳原子和氧原子之间通过共价双键形成的共价化合物,电子式为:
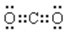
,氟离子核外电子数为10,离子的结构示意图为:
,故答案为:
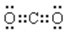
;

;
(3)二氧化碳是分子晶体,二氧化硅是原子晶体,分子晶体的熔点低于原子晶体,故答案为:分子;原子;
(4)同主族元素的原子,从上到下氢化物越来越稳定,所以元素F的气态氢化物比元素Cl的气态氢化物稳定,故答案为:稳定;
(5)元素f的最高价氧化物对应水化物是氢氧化钠,g的最高价氧化物对应水化物是氢氧化铝,氢氧化铝是两性氢氧化物,能和强碱反应,实质是:Al(OH)3+OH-=[Al(OH)4]-,故答案为:Al(OH)3+OH-=[Al(OH)4]-;
(6)氢氧化钠中钠离子和氢氧根之间是离子键,氧和氢之间是共价键,故答案为:离子键和共价键.
本题解析:
本题难度:一般
3、选择题 某短周期非金属元素的原子核外最外层电子数是次外层电子数的一半,该元素
[? ]
A.在自然界中只以化合态存在
B.单质常用作半导体材料和光导纤维
C.最高价氧化物不与酸反应
D.气态氢化物比甲烷稳定
参考答案:A
本题解析:
本题难度:简单
4、选择题 A和B是前三周期元素,它们的离子A2-和B3+具有相同的核外电子层结构,下列说法中正确的是
A.原子序数A>B
B.原子半径A>B
C.离子半径A2->B3+
D.质量数为A>B
参考答案:C
本题解析:由离子的结构关系易知B在A的下一周期,原子序数B>A,原子半径B>A;离子半径A2->B3+;质量数应是B>A.
本题难度:简单
5、简答题 下表是元素周期表的一部分.
族
周期 | I?A | II?A | III?A | IV?A | V?A | VI?A | VII?A
一
|
二
a
b
?d
e
三
f
g
h
j
|
(1)表中元素的单质中熔点最高的可能是______(填元素符号);写出a的氯化物的电子式______;e、f、h形成的简单离子的半径由大到小顺序依次为______(填离子符号).
(2)在一定条件下,j与d可形成一种化合物,常温下为淡黄色液体,则其晶体类型为______.该物质遇水强烈水解,生成两种产物,其中之一的分子构型为三角锥形,另一种物质具有漂白性,写出相关反应的化学方程式______.
(3)现有一种元素,其原子获得一个电子所释放出能量是上表中所列元素中最大的,该元素是表中______元素(填编号).
(4)在g的单质中添加f单质,形成物质k,则g、f、k中硬度最大的是______(填物质名称).
(5)若制得117号元素,按元素周期表中金属与非金属的分区,它应是一种______(选填“金属”“非金属”)元素,写出117号元素最外层电子排布式______.
(6)试用短周期元素,写出两种中心原子杂化轨道类型不同的AB3型分子的化学式______、______.
参考答案:由元素在周期表中位置可知a为Li元素;b为C元素;d为N元素;e为F元素;f为Mg元素;g为Al元素;h为S元素;j为Cl元素.
(1)碳单质存在原子晶体,故碳元素单质熔点可能最高;氯化锂由锂离子与氯离子构成,电子式为
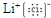
;电子层结构相同,核电荷数越大,离子半径越小,所以离子半径F->Mg2+,最外层电子数相同,电子层越多离子半径越大,所以离子半径S2->F-,所以离子半径S2->F->Mg2+;
故答案:C;
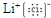
;S2->F->Mg2+;
(2)j与d形成化合物是NCl3,常温下为淡黄色液体,沸点较低,属于分子晶体.NCl3遇水强烈水解,生成两种产物,其中之一的分子构型为三角锥形为NH3,另一种物质具有漂白性是HClO,反应方程式为NCl3+3?H2O═NH3+3HClO,
故答案为:NCl3+3?H2O═NH3+3HClO;
(3)同周期自左而右,电负性增大,同主族自上而下,电负性减小.所以电负性最大是F元素,F原子获得一个电子所释放出能量最多,故答案为:e;
(4)合金的硬度高于各组分,所以铝镁合金硬度最大,故答案为:铝镁合金;
(5)第七周期0族元素为118号,所以117号元素处于第七周期第ⅦA族,最外层电子排布式为7s27p5,最外层电子数≤电子层数,属于金属元素,
故答案为:金属;7s27p5;
(6)AB3型分子可能为三角锥型,如NH3,N原子采取sp3杂化;也可能是平面三角形,如BF3,B原子采取sp2杂化,故答案为:NH3;BF3.
本题解析:
本题难度:一般