1、选择题 元素A的阳离子与元素B的阴离子具有相同的电子层结构.以下关于A、B元素的比较中,不正确的是
A.原子半径:A<B
B.原子序数:A>B
C.原子最外层电子数:B>A
D.元素所在的周期数:A>B
参考答案:A
本题解析:本题考查原子结构,较易题.元素A的阳离子与元素B的阴离子具有相同的电子层结构,假设A为Na,B为F,检验可知,选项A错,B、C、D都正确.
本题难度:一般
2、填空题 某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表(表中的“实验方案”与“实验现象”前后不一定是对应关系)
| 实验方案 | 实验现象
①用砂纸擦后的镁带与沸水反应,再向反应液中滴加酚酞
A.浮于水面,熔成小球,在水面上无定向移动,随之消失,溶液变成红色
②钠与滴有酚酞试液的冷水反应
B.有气体产生,产生的气体可在空气中燃烧,溶液变成浅红色
③镁带与2mol/L的盐酸反应
C.反应不十分剧烈,产生的气体可以在空气中燃烧
④铝条与2mol/L的盐酸反应
D.生成白色胶状沉淀,继而沉淀消失
⑤向氯化铝溶液中滴加氢氧化钠溶液至过量
E.剧烈反应,产生的气体可以在空气中燃烧
|
请你帮助该同学整理并完成实验报告
(1)实验目的:______
(2)实验用品:仪器:①砂纸②______③______④______⑤试管夹、试管架⑥滤纸⑦镊子⑧小刀⑨玻璃片⑩锥形瓶(100mL)等;
药品:钠、镁条、铝条、2mol/L的盐酸、AlCl3溶液、氢氧化钠溶液等.
(3)实验内容:(填写与实验方案相对应的实验现象和有关离子方程式)
| 实验方案 | 实验现象
(填写字母) | 有关离子方程式
①
______
Mg+2H2O(热水)═Mg(OH)2+H2↑
②
______
______
③
______
Mg+2H+═Mg2++H2↑
④
______
______
⑤
______
补全离子方程式
Al3++3OH-=______
Al(OH)3+OH-=______
|
(4)实验结论:______.
参考答案:(1)根据题意“某同学做同周期元素性质递变规律实验时”以及所做实验可以判断,本实验的实验目的是:验证第三周期金属元素的金属性的递变规律.
故答案为:验证第三周期金属元素的金属性的递变规律;
(2)②做钠与滴有酚酞试液的冷水反应,一般应在烧杯中进行,③做镁带与2mol/L的盐酸反应,一般要在试管中进行,④做铝条与2mol/L的盐酸反应,一般要在试管中反应,
故答案为:②烧杯 ③试管 ?④试管;
(3)①用砂纸擦后的镁带与沸水反应,再向反应液中滴加酚酞,其现象应是:有气体产生,产生的气体可在空气中燃烧,溶液变成浅红色,即B.②钠与滴有酚酞试液的冷水反应,
反应方程式是2Na+H2O═2NaOH+H2↑,其离子方程式是2Na+H2O═2Na-+2OH-+H2↑,其现象应该是:浮于水面,熔成小球,在水面上无定向移动,随之消失,溶液变成红色,即A.③镁
带与2mol/L的盐酸反应,其现象应是:剧烈反应,产生的气体可以在空气中燃烧,即E.值得注意的是镁比铝活泼,因此与盐酸反应,镁比铝剧烈.④铝条与2mol/L的盐酸反应,其
化学方程式是2Al+6HCl═2AlCl3+3H2↑,即离子方程式是2Al+6H+═2Al3++3H2↑,其现象是:反应不十分剧烈,产生的气体可以在空气中燃烧,即C.⑤向氯化铝溶液中滴加氢氧化
钠溶液至过量,其现象:生成氢氧化铝白色胶状沉淀,继而在氢氧化钠过量时氢氧化铝与氢氧化钠反应使沉淀消失,即D.本实验发生反应的离子方程式是:Al3++3OH-═Al(OH)3↓,
Al(OH)3+OH-═AlO2-+2H2O.故答案为:①B;?②A;2Na+H2O═2Na-+2OH-+H2↑;③E;④C;2Al+6H+═2Al3++3H2↑;⑤D;Al3++3OH-═Al(OH)3↓,Al(OH)3+OH-═AlO2-+2H2O;?
(4)根据实验①②,说明与水反应时钠比镁剧烈,即钠的金属性比镁强.根据③④,说明与同浓度的盐酸反应,铝比镁剧烈,即铝的金属性比镁强.⑤说明氢氧化铝既能与酸反应,又能与碱反应,即氢氧化铝既有酸性又有碱性,因此铝既有金属性又有非金属性.由以上分析第三周期,金属元素的金属性由强到弱的顺序是:Na>Mg>Al,即同周期从左到右元素的金属性逐渐减弱.故答案为;同周期从左到右元素的金属性逐渐减弱.
本题解析:
本题难度:一般
3、选择题 位于同一周期的五种短周期元素A、B、C、D、E它们的原子序数依次增大,已知A、B为金属,其余为非金属。A、B原子序数之和数值上等于A元素的原子量;C、D的最外层电子数均为偶数;电解熔融的化合物BE2是工业上生产单质B的方法。下列叙述正确的是
[? ]
A.A的氧化物的熔点大于B的氧化物
B.C既能与强酸溶液也能与强碱溶液反应
C.D、E的单质均能与氧气直接化合生成其最高价氧化物
D.含A、E元素的某物质具有漂白作用
参考答案:D
本题解析:
本题难度:一般
4、选择题 图表资料可以为我们提供很多信息。下面是某学生对图表资料的使用,其中不正确的是
[? ]
A.根据金属活动顺序表,判断某金属能否置换出稀硫酸中的氢
B.根据熔点数据表,判断降低温度时,两种固体物质混合溶液中哪种物质先析出
C.根据元素周期表,判断同主族两种元素的阳离子在用惰性电极电解其水溶液时,何者先发生反应
D.根据酸碱盐的溶解性表,判断某些复分解反应能否发生
参考答案:BC
本题解析:
本题难度:一般
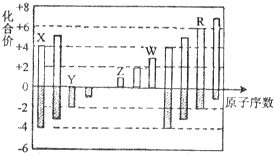
5、选择题 短周期元素X、Y、Z、W、R的化合价与原子序数的关系如图所示.下列说法正确的是( )
A.原子半径:Z>Y>X
B.气态氢化物的稳定性:Y<R
C.Z和Y形成的化合物是离子化合物
D.常温下单质W能溶于R的最高价氧化物对应水化物的浓溶液