1、选择题 根据所学的元素周期律知识,下列说法正确的是( )
A.碱金属元素从上到下随核电荷数的增加,单质的熔沸点逐渐升高
B.第二周期元素(除稀有气体外)从左到右随核电荷数的增加,其最高正价从+1到+7
C.Sr的碳酸盐应该难溶于水
D.Se的氢化物应该比硫化氢稳定
参考答案:A、因碱金属属于金属晶体,从上到下,半径增大,金属键减弱,则单质的熔沸点逐渐降低,故A错误;
B、因第二周期元素中O、F没有正价,在第三周期中(除稀有气体外)从左到右随核电荷数的增加,其最高正价从+1到+7,故B错误;
C、Sr与Ca同主族,碳酸钙不溶于水,则可知Sr的碳酸盐应该难溶于水,故C正确;
D、S、Se同主族,非金属性S>Se,则Se的氢化物不如硫化氢稳定,故D错误;
故选C.
本题解析:
本题难度:一般
2、推断题 A、B、C、D、E、F均为短周期元素,其原子序数逐渐增大.A、B、C三种元素原子核外电子层数之和为5.A、B两种元素的原子最外层电子数之和等于C元素原子最外层的电子数;B元素原子最外层的电子数是其电子层数的2倍,B与D的质子数之比为3∶4.A和C可以形成化合物CA3.E与D同主族,E与F同周期且原子半径是E>F. 回答下列问题:
(1)B的最高价氧化物的电子式为_____________________.
(2)化合物C2A2分子中各原子的最外层均达到稳定结构,该分子的结构式为________________________________________________.
(3)能说明E、F的非金属性强弱关系的化学方程式为 ________________________.
(4)化合物A4C2D3的溶液呈酸性的离子方程式为 ______________________________.
参考答案:(1) 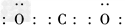
(2)H-N=N-H
(3)Cl2+H2S==2HCl+S↓
(4)NH4++H2O NH3·H2O+H+
NH3·H2O+H+
本题解析:
本题难度:一般
3、选择题 下列说法正确的是
A.第ⅤA族元素都是非金属元素
B.磷比氮更难与H2化合成气态氢化物
C.气态氢化物的稳定性:PH3<NH3<AsH3
D.酸性:HNO3>H3PO4>H2SO4
参考答案:B
本题解析:
本题难度:困难
4、推断题 一种常用融雪剂的主要成分的化学式为XY2,X原子的结构示意图为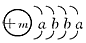 ,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
(1)m=________,该融雪剂的化学式为________。
(2)Z、W元素的名称为________、________
(3)下列说法正确的是________。
A.XY2和WZ2都为离子化合物
B.XY2中仅含离子键,WZ2中仅含极性共价键
C.H2Z比HY的稳定性强
D.X的阳离子比Y的阴离子半径大
(4)下列化学用语表达正确的是________.
A.XY2的电子式: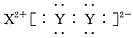
B.WZ2的结构式:Z=W=Z
C.Y元素的单质与H2Z水溶液反应的离子方程式为:Y2+Z2-===2Y-+Z↓
D.用电子式表示XY2的形成过程为: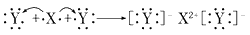
(5)冰雪的化学成分是H2O,水的沸点比H2Z的沸点高,其原因是_____________________。
参考答案:(1)20;CaCl2
(2)硫;碳
(3)B
(4)BD
(5)水分子间存在氢键
本题解析:
本题难度:一般
5、选择题 下列排列顺序正确的是( )
A.固体热稳定性:Na2CO3>CaCO3>NaHCO3
B.微粒半径:Fe(OH)3胶粒>K+>C1->Na+
C.给出质子的能力:CH3COOH>C2H5OH>H2O
D.氢化物的沸点:H2Se>H2S>H2O
参考答案:A、碳酸钠稳定不分解,碳酸钙高温分解,碳酸氢钠加热分解,固体热稳定性:Na2CO3>CaCO3>NaHCO3,故A正确;
B、Fe(OH)3胶粒是很多Fe(OH)3集合体,大于溶液离子;电子层排布相同,核电荷数越大离子半径越小,所以C1->K+,最外层电子数相同,电子层越多,离子半径越大,所以K+>Na+,微粒半径:Fe(OH)3胶粒>C1->K+>Na+,故B错误;
C、醋酸属于酸,溶于水呈酸性,水为弱电解质,可以电离出氢离子,呈中性;乙醇是非电解质,不能电离出氢离子,给出质子的能力:CH3COOH>H2O>C2H5OH,故C错误;
D、水分子键存在氢键,高于同族其它元素氢化物,沸点最高,H2Se、H2S结构相似,相对分子质量越大,分子间作用力越强,沸点越高,故氢化物的沸点:H2O>H2Se>H2S,故D错误.
故选A.
本题解析:
本题难度:简单