|
高考化学试题《热化学方程式》试题巩固(2020年最新版)(十)
2021-02-18 06:39:37
【 大 中 小】
|
1、选择题 灰锡(以粉末状存在)和白锡是锡的两种同素异形体。
已知:
①Sn(s、白)+2HCl(aq)=SnCl2(aq)+H2(g);△H1
②Sn(s、灰)+2HCl(aq)=SnCl2(aq)+H2(g);△H2
③Sn(s、灰)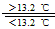 Sn(s、白);△H3=+2.1 kJ/mol Sn(s、白);△H3=+2.1 kJ/mol
下列说法正确的是
[? ]
A.△H1>△H2
B.锡在常温下以灰锡状态存在
C.灰锡转化为白锡的反应是放热反应
D.锡制器皿长期处于低于13.2 ℃的环境中,会自行毁坏
参考答案:D
本题解析:
本题难度:简单
2、填空题 为了减少CO对大气的污染,某研究性学习小组拟研究CO和H2O反应转化为绿色能源H2。已知:
2CO(g)+O2(g)=2CO2(g) △H=-566kJ·moL-1
2H2(g)+O2(g)=2H2O(g) △H=-483.6KJ·moL-1
H2O (g)=H2O(l) △H=-44.0KJ·moL-1
(1)氢气的标准燃烧热△H= kJ·moL-1
(2)写出CO和H2O(g)作用生成CO2和H2的热化学方程式
(3)往 1L体积不变的容器中加入1.00mol CO和1.00mol H2O(g),在t℃时反应并达到平衡,若该反应的化学平衡常数K=1,则t℃时CO的转化率为 ;反应达到平衡后,升高温度,此时平衡常数将 (填“变大”、“不变”或“变小”),平衡将向 (填“正”或“逆”)方向移动。
(4)在CO和H2O反应转化为绿色能源H2中,为了提高CO的转化率,可采取的措施是 。
A.增大的CO浓度
B.增大的H2O(g)浓度
C.使用催化剂
D.降低温度
|
参考答案:(共11分)(1)-285.8(2分)
(2)CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41.2kJ/mol(3分)
(3)50%(2分);变小(1分);逆(1分) (4)BD(2分)
本题解析:(1)通常条件下,1mol氢气完全燃烧生成液态水放出的热量为氢气的燃烧热。已知反应①2H2(g)+O2(g)=2H2O(g) △H=-483.6KJ·moL-1、②H2O (g)=H2O(l) △H=-44.0KJ·moL-1,则根据盖斯定律可知,①×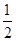 +②即得到反应H2(g)+ +②即得到反应H2(g)+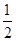 O2(g)=H2O(g),所以该反应的△H=-483.6KJ?moL-1÷2+-44.0KJ·moL-1=-285.8KJ?moL-1,即氢气的标准燃烧热△H=-285.8KJ?moL-1。 O2(g)=H2O(g),所以该反应的△H=-483.6KJ?moL-1÷2+-44.0KJ·moL-1=-285.8KJ?moL-1,即氢气的标准燃烧热△H=-285.8KJ?moL-1。
(2)已知反应①2CO(g)+O2(g)=2CO2(g) △H=-566kJ·moL-1、②2H2(g)+O2(g)=2H2O(g) △H=-483.6KJ·moL-1,则根据盖斯定律可知,(①-②)÷2即得到反应CO(g)+H2O(g)=CO2(g)+H2(g) ,所以该反应的分液△H=(-566kJ·moL-1+483.6KJ·moL-1)÷2=-41.2kJ/mol。(3)(3)令参加反应的CO的物质的量浓度为nmol/L,则:
CO(g)+H2O(g) CO2(g)+H2(g) CO2(g)+H2(g)
起始浓度(mol/L)1 1 0 0
转化浓度(mol/L)n n n n
平衡浓度(mol/L)1-n 1-n n n
所以根据平衡常数可知K= = =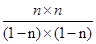 =1 =1
解得n=0.5mol/L
所以t℃时CO的转化率为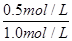 ×100%=50% ×100%=50%
由(2)可知该反应正反应是放热反应,升高温度平衡向逆反应移动,平衡常数变小。
(4)A、增大的CO浓度,平衡向正反应移动,但CO的转化率降低,故A错误;B、增大的H2O(g)浓度,平衡向正反应移动,但CO的转化率增大,故B正确;C、使用催化剂加快反应速率,平衡不移动,CO转化率不变,故C错误;D、降低温度平衡向正反应移动,但CO的转化率增大,故D正确,答案选BD。
考点:考查燃烧热计算、热化学方程式的书写;外界条件对平衡状态的影响;平衡常数的计算和应用等
本题难度:困难
3、填空题 (16分)氢是一种理想的绿色清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。 利用FeO/Fe3O4循环制氢,已知:
H2O(g)+3FeO(s) Fe3O4(s) + H2(g) △H="a" KJ/mol (Ⅰ) Fe3O4(s) + H2(g) △H="a" KJ/mol (Ⅰ)
2Fe3O4(s)=6FeO(s) + O2(g) △H="b" KJ/mol (Ⅱ)
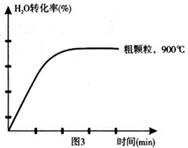
下列坐标图分别表示FeO的转化率(图1)和一定温度时,H2生成速率[细颗粒(直径0.25 mm),粗颗粒(直径3 mm)](图2)。

(1)反应:2H2O(g)=2H2(g) + O2(g) ΔH= (用含a、b代数式表示);
(2)在上述循环制氢的过程中FeO的作用是: ;
(3)900°C时,在两个体积均为2L密闭容器中分别投入0.60molFeO和0.20mol H2O(g),甲容器用细颗粒FeO,乙容器用粗颗粒FeO。
①用细颗粒FeO和粗颗粒FeO时,H2生成速率不同的原因是: ;
②用细颗粒FeO时,H2O (g)的转化率比用粗颗粒FeO时H2O(g)的转化率 (填“大”或“小”或“相等”);
③求此温度下该反应的平衡常数K(写出计算过程)。
(4)在坐标图3中画出在1000°C、用细颗粒FeO时,H2O(g)转化率随时间变化示意图(进行相应的标注):
参考答案:(1)(2a+b)kJ/mol (2分)(无kJ/mol或“2a+bkJ/mol”扣1分,其他不给分)
(2)作催化剂(2分)
(3)①细颗粒FeO表面积大,与H2的接触面大,反应速率加快;
(3分)(“增大接触面、加快反应速率”、“接触面越大,反应速率越快”等合理表达给3分;答“增大反应物浓度”、“FeO的量增加,反应速率加快”给1分);
②相等(2分)(答“等于”、“=”给1分)
③(4分)解:900℃时,达到平衡FeO转化的量为:n(FeO)=0.60mol×40%=0.24mol,
H2O(g)+3FeO(s) Fe3O4(s)+ H2(g) Fe3O4(s)+ H2(g)
开始(mol):0.2 0.6 0 0
转化(mol):0.08 0.24 0.08 0.08
平衡(mol):0.12 0.36 0.08 0.08
K= =0.6 =0.6
(4) (3分) (3分)
本题解析:(1)已知H2O(g)+3FeO(s) Fe3O4(s)+H2(g)△H=akJ/mol(Ⅰ),2Fe3O4 Fe3O4(s)+H2(g)△H=akJ/mol(Ⅰ),2Fe3O4
本题难度:困难
4、简答题 ①已知:
(1)Zn(s)+ O2(g)═ZnO(s)△H=-348.3kJ/mol
(2)2Ag(s)+O2(g)═Ag2O(s)△H=-31.0kJ/mol
则Zn与Ag2O反应生成ZnO和Ag的热化学方程式______.
②在25℃、101kPa下,1?6g甲醇燃烧生成CO2和液态水时放热362.88kJ.则表示甲醇燃烧热的热化学方程式为______.
③已知热化学方程式:SO2(g)+O2(g)?SO3(g)△H=-98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为______.
参考答案:①已知:(1)Zn(s)+12O2(g)═ZnO(s)△H=-348.3kJ/mol
(2)2Ag(s)+12O2(g)═Ag2O(s)△H=-31.0kJ/mol
由盖斯定律,(1)-(2)得已知:Zn(s)+Ag2O(s)═ZnO+2Ag(s)△H=-317.3kJ/mol
故答案为:Zn(s)+Ag2O(s)═ZnO+2Ag(s)△H=-317.3kJ/mol.
②16g甲醇燃烧生成CO2和液态水时放热362.88kJ,16g甲醇的物质的量为16g32g/mol=0.5mol,1mol甲醇燃烧生成CO2和液态水时放热362.88kJ×2=725.76kJ,表示甲醇燃烧热的热化学方程式为:
CH3OH(l)+32O2(g)═CO2(g)+2H2O(l)△H=-725.76kJ/mol.
故答案为:CH3OH(l)+32O2(g)═CO2(g)+2H2O(l)△H=-725.76kJ/mol.
③已知热化学方程式:SO2(g)+12O2(g)?SO3(g)△H=-98.32kJ/mol,所以1molSO2与0.5molO2完全,放出热量
98.32kJ,SO2和O2反应为可逆反应,容器中充入2molSO2和1molO2,SO2和O2不能完全反应,反应的SO2物质的量小于
2mol,所以放出的热量小于98.32kJ×2=196.64kJ.
故答案为:小于196.64kJ.
本题解析:
本题难度:一般
5、填空题 (6分)PM2.5(可入肺颗粒物)污染跟冬季燃煤密切相关,燃煤还同时排放大量的CO2、SO2和NOx最近有科学家提出构想:把空气吹入饱和碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。
①已知在常温常压下:
2CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(g) ?H = -1275.6 kJ/mol
2CO(g)+O2(g)=2CO2(g) ?H = -566.0 kJ/mol
H2O(g)=H2O(1) ?H = -44.0 kJ/mol
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_____________________。
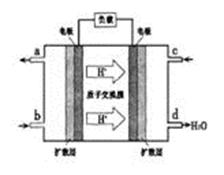
②以甲醇和氧气反应制成的燃料电池如图所示,该电池工作过程中O2应从______(填“c”或“b”)口通入,电池正极反应式为__________________。
参考答案:CH3OH(l)+O2(g)==CO(g)+2H2O(l) H="-442.8" kJ/mol C ;O2+4e-+4H+=2H2O
本题解析:
诗题分析:①将三个方程式分别标记为abc,利用盖斯定律,a-b+c×4得2摩尔甲醇不完全燃烧生成一氧化碳和液态水的反应热为-1275.6-(-556.0)+4×(-44.0)="-885.6" kJ/mol。②通过图片信息可知,氢离子向正极移动,所以右侧为燃料电池的正极,氧气在正极反应,故从C口通入,电极反应式为:O2+4e-+4H+=2H2O。
考点:盖斯定律,燃料电池。
本题难度:一般
|