| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点整理《常见的化学电源》试题预测(2020年最新版)(十)
参考答案:D 本题解析:根据给出的电极反应看出,通入CH4的一极是负极,通入O2的另一极是正极。正极发生还原反应,A对;通入CH4的电极为负极,B对;对比两个电极反应,可知消耗的OH-比生成的多,所以随着反应的进行,KOH的浓度会降低,所以需要补充KOH,C对;原电池中阴离子向负极移动,OH-向负极移动,D错。 本题难度:困难 2、选择题 目前已研制出一种用磺酸类质子作溶剂的酸性乙醇电池,其效率比甲醇电池高出32倍,电池构造如图所示,电池反应式为:C2H5OH+3O2=2CO2+3H2O。下列关于该电池的说法正确的是 |
参考答案:C
本题解析:乙醇作为一种燃料,在反应中失去电子,被氧化,因此在燃料电池中乙醇在负极上发生反应,A错误;负极失去电子,电子沿导线传递到正极上,因此溶液中的阳离子向正极移动,阴离子向负极移动B错误;氧气在正极反应,C正确;乙醇中碳原子的化合价是+2价,而在产物中碳原子的化合价是+4价,即1个碳原子失去6个电子,所以1mol乙醇转移12mol电子,消耗0.2mol乙醇转移2.4mol电子,电解池的阴极生成氢气,生成氢气的物质的量为x,根据转移电子数守恒,2x=2.4mol,x=1.2mol,故生成氢气的体积为1.2molx22.4L/mol=26.88L,D错误,答案选C.
考点:电解池和原电池原理
本题难度:困难
3、填空题 .⑴今有2H2+O2 2H2O反应,设计成燃料电池,则负极通的应是?,正极通的应是?,电极反应式为:?、?。
2H2O反应,设计成燃料电池,则负极通的应是?,正极通的应是?,电极反应式为:?、?。
⑵如把KOH改为稀H2SO4作电解质,则电极反应式为:?、
?。⑴和⑵的电解液不同,反应进行后,其溶液的PH值变化为?、?。
⑶如把H2改为甲烷,KOH作电解质,则负极反应式为:?。
参考答案::⑴H2? O2?负极:2H2+4OH-→4H2O+4e-;正极:O2 + 2H2O + 4e-→ 4OH-;⑵负极:2H2→4H++4e-;正极:O2+4H++4e-→2H2O;⑴中变小,⑵中变大;⑶负极:CH4+10OH―=CO32-+7H2O+8e―。
本题解析:依据原电池的原理应用。首先考虑原电池反应所依据的氧化还原反应,再考虑产物与电解质溶液的反应。⑴⑵两问中原电池反应为2H2+O2=2H2O,最后一问原电池反应为CH4+2O2+2KOH=K2CO3+3H2O。
本题难度:一般
4、填空题 (10分)如图所示的实验装置中,E为一张用淀粉、碘化钾和酚酞混合溶液润湿的滤纸,C、D为夹在滤纸两端的铂夹;x、y分别为直流电源的两极。在A、B中充满KOH溶液后倒立于盛有KOH溶液的水槽中,再分别插入一多孔的惰性电极。切断电源开关S1,闭合开关S2,通直流电一段时间后,生成气体如图所示。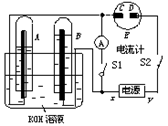
请回答下列问题:
(1)标出电源的正、负极:x为 。
(2)在滤纸的C端附近,观察到的现象是 。
参考答案:
本题解析:
本题难度:一般
5、选择题 镍氢电池是近年来开发出来的可充电电池,它可以取代会产生镉污染的镍镉电池.镍氢电池的总反应式是:
| 1 2 |
参考答案:A、电池放电时,负极反应式为:H2-2e-+2OH-=2H2O,所以电池周围溶液的氢氧根离子减少,溶液的PH值减小,故A错误.
B.电池放电时,正极反应为:NiO(OH)+H2O+e-=OH-+Ni(OH)2,镍元素被还原,故B错误;
C.充电时,阴极反应为,2H2O+2e-=H2+2OH-,氢元素被还原,故C正确;
D.电池放电时,负极反应为H2-2e-+2OH-=2H2O,H2是负极,故D错误.
故选C.
本题解析:
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学试题《物质的分离、提纯.. | |