|
高考化学试题《气体的净化、干燥、吸收与收集》高频试题强化练习(2020年最新版)(八)
2021-02-18 06:45:33
【 大 中 小】
|
1、填空题 以下是某同学测定硫酸钠晶体中结晶水含量的实验方案。
实验用品:硫酸钠晶体试样、研钵、干燥器、坩埚、三脚架、玻璃棒、药匙、托盘天平
实验步骤:
① 准确称量一个干净、干燥的坩埚;
② 在坩埚中加入一定量的硫酸钠晶体试样,称重,将称量的试样放入研钵中研细,再放回到坩埚中;
③ 将盛有试样的坩埚加热,待晶体变成白色粉末时,停止加热;
④ 将步骤③中的坩埚放入干燥器,冷却至室温后,称重;
⑤ 将步骤④中的坩埚再加热一定时间,放入干燥器中冷却至室温后称量。重复本操作,直至两次称量结果不变;
⑥ 根据实验数据计算硫酸钠晶体试样中结晶水的质量分数。
分析该方案并回答下面问题:
(1)完成本实验还需要的实验用品是?;
(2)指出实验步骤中存在的错误并改正:?;
(3)硫酸钠不能放置在空气中冷却的原因是?;
(4)步骤⑤的目的是?;
(5)下面的情况有可能造成测试结果偏高的是?(填序号)。
A.试样中含有加热不挥发的杂质
B.试样中含有加热易挥发的杂质
C.测试前试样已有部分脱水
D.实验前坩埚未完全干燥
| E.晶体加热脱水不完全
F.加热时有晶体溅出
参考答案:(1)坩埚钳、酒精灯(可以不答“火柴”)
(2)步骤②有错误?应先将试样研细,后放入坩埚称重
(3)因硫酸钠放置在空气中冷却时,会吸空气中的水分
(4)保证试样脱水完全
(5)B、D、F
本题解析:
【错解分析】注意实验用品的选择,不多不漏,明确实验目的,实验步骤和实验现象。
【正解】对实验的基本操作不熟悉,致使第(1)题选错实验仪器,如漏填坩埚钳等。对所含结晶水的质量分数的计算式理解不透彻或不会分析,而使第(5)题多选C等。
【正确解答】本题是一个定量实验,实验的目的是测定硫酸钠晶体中结晶水的质量分数。
(1)根据实验步骤结合已经给知的实验仪器,可以得出使用坩埚时必须使用坩埚钳进行挟持。因实验需要加热坩埚,因此需要使用酒精灯、泥三角等仪器。
(2)将各步实验进行观察和分析,会发现步骤②中的称量存在问题:若先称量样品再在研钵种研细,必然会导致部分样品附着在研钵上而损失部分样品。正确的操作应为先用研钵将样品研细,再进行称量。
(3)硫酸钠晶体加热失去结晶水后生成的无水硫酸钠,若在空气中冷却又会重新吸生成硫酸钠晶体,因此应将失水后的硫酸钠放于干燥器中进行冷却。
(4)实验步骤⑤的目的是保证试样脱水完全。
(5)假设步骤①中坩埚的质量为m1,步骤②中坩埚和样品的质量为m2,步骤⑤中称量的质量为m3。则硫酸钠晶体中结晶水的质量分数为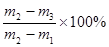 ,A选项试样中含有加热不挥发的杂质,将会使m3偏大,结果偏小;B选项中试样中含有加热易挥发的杂质,将会使m3偏小,结果偏大;C选项中测试前试样已有部分脱水,将会使m2-m3的值偏小,结果偏小;D选项中实验前坩埚未完全干燥将会使m1偏大,结果偏大;E选项中晶体加热脱水不完全,将会使m3偏大,结果偏小;F选项中加热时有晶体溅出,将会使m3偏小,结果偏大。 ,A选项试样中含有加热不挥发的杂质,将会使m3偏大,结果偏小;B选项中试样中含有加热易挥发的杂质,将会使m3偏小,结果偏大;C选项中测试前试样已有部分脱水,将会使m2-m3的值偏小,结果偏小;D选项中实验前坩埚未完全干燥将会使m1偏大,结果偏大;E选项中晶体加热脱水不完全,将会使m3偏大,结果偏小;F选项中加热时有晶体溅出,将会使m3偏小,结果偏大。
本题难度:一般
2、实验题 (17分)甲学生急需3.0 mol·L-1稀硫酸做探究性实验,而此时实验室只有18.4 mol·L-1浓硫酸。请你为他配制100 mL 3.0 mol·L-1稀硫酸。
(1)建议配制过程如下:
①计算所需浓硫酸的体积是?(准确到小数点后一位),量取浓硫酸所用的量筒的规格是?(从下列中选用A.10 mL B.25 mL C.50 mL D.100 mL)。
②稀释。具体操作过程是?。
③待上步得到的稀释液充分冷却后,借助玻璃棒引流,注入?。用蒸馏水洗涤烧杯内壁和玻璃棒2-3次,洗涤液也注入其中。轻轻摇动容量瓶,使溶液混合均匀。
④将蒸馏水注入容量瓶,待液面离容量瓶刻度线1-2cm,改用?加水至液面与刻度线相切。盖好瓶塞,反复上下颠倒、摇匀。
⑤将配好的溶液转移到试剂瓶中,交甲同学使用。
(2)在配制溶液过程中,遇到下列情况时,实际浓度会怎样?(填偏高、偏低或不影响)
A.所用的浓硫酸长时间放置在密封不好的容器中?
B.容量瓶用蒸馏水洗涤后残留有少量的水?
C.所用过的烧杯、玻璃棒未洗涤??
D.定容时俯视刻度线??
参考答案:16.3mL? B或25mL(1分,其它每空2分)?沿装有水的烧杯内壁缓缓注入浓硫酸,边加边搅拌? 100mL容量瓶?胶头滴管?偏低?不影响?偏低?偏高
本题解析:(1)1、设浓硫酸的体积为V,18.4mol/L×V=0.1L×3.0mol/L,V=0.0163L=16.3mL;选取量筒的容积应稍大于或等于量取溶液的体积,故选B。
故答案为:16.3ml;B;
然后将浓硫酸沿烧杯内壁缓慢倒入烧杯中,并用玻璃棒搅拌,防止液体飞溅,
故答案为:沿装有水的烧杯内壁缓缓注入浓硫酸,边加边搅拌;
3、洗涤液要转移到100mL容量瓶中,故答案为:100mL容量瓶;
4、将蒸馏水注入容量瓶,待液面离容量瓶刻度线1-2cm,改用 胶头滴管加水至液面与刻度线相切.盖好瓶塞,反复上下颠倒、摇匀。
故答案为:胶头滴管;
(2)A.所用的浓硫酸长时间放置在密封不好的容器中,浓硫酸有吸水性,导致溶质的物质的量偏小,配制溶液的浓度偏低;
B.容量瓶用蒸馏洗涤后残留有少量的水,不影响溶质的物质的量和溶液的体积,所以配制溶液的物质的量浓度无影响。
C.所用过的烧杯、玻璃棒未洗涤,导致溶质的物质的量偏小,配制的溶液浓度偏低;
D.定容时俯视溶液的液凹面,导致溶液的体积偏小,所以配制溶液的浓度偏高。
故答案为:偏低;无影响;偏低;偏高.
点评:本题考查了一定物质的量浓度溶液的配制,难度不大,会根据量取浓硫酸的体积选择量筒
本题难度:一般
3、选择题 不能用排空气法收集的气体是( )
A.CO2
B.NO2
C.NO
D.H2
参考答案:A、CO2密度比空气大,不与氧气反应,可以用排空气法收集,故A正确;
B、NO2密度比空气大,不与氧气反应,可以用排空气法收集,故B正确;
C、NO与氧气反应生成NO2,不可以用排空气法收集,故C错误;
D、通常条件下H2不与氧气反应,可以用排空气法收集,故D正确;
故选C
本题解析:
本题难度:简单
4、实验题 下图所示为常见气体制备、分离、干燥和性质验证的部分仪器装置(加热设备及夹持固定装置均略去),请根据要求完成下列各题(仪器装置可任意选用,必要时可重复选择,a、b为活塞)。

(1)若气体入口通入CO和CO2的混合气体,E内放置CuO,选择装置获得纯净干燥的CO,并验证其还原性及氧化产物,所选装置的连接顺序为___________ (填代号)。能验证CO氧化产物的现象是___________________________________。
(2)停止CO和CO2混合气体的通入,E内放置Na2O2,按A→E→D→B→H装置顺序制取纯净干燥的O2,并用O2氧化乙醇。此时,活塞a应________,活塞b应_________,需要加热的仪器装置有___________(填代号),m中反应的化学方程式为______________________________。
(3)若气体入口改通空气,分液漏斗内改加浓氨水,圆底烧瓶内改加NaOH固体,E内放置铂铑合金网,按A→G→E→D装置顺序制取干燥氨气,并验证氨的某些性质。
①装置A中能产生氨气的原因有:____________________________。
②实验中观察到E内有红棕色气体出现,证明氨气具有___________性。
参考答案:(1)ACBECF;AB之间的C装置中溶液保持澄清,EF之间的C装置中溶液变浑浊
(2)关闭;打开;k、m;2CH3CH2OH+O2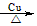 2CH3CHO+2H2O 2CH3CHO+2H2O
(3)①氢氧化钠溶于水放出大量热,温度升高,使氨的溶解度减小而放出,氢氧化钠吸水,促使氨放出,
氢氧化钠电离出的OH-增大了氨水中OH-浓度,促使氨水电离平衡左移,导致氨气放出;
②还原。
本题解析:
本题难度:困难
5、选择题 实验室为了制取干燥的氨气,下列方法中适合的是(?)
A.NH4Cl和H2SO4(浓)混合加热,生成的气体用碱石灰干燥
B.N2 + H2→ NH3,用烧碱干燥
C.氯化铵和氢氧化钙固体混合加热,气体用碱石灰干燥
D.向浓氨水中加入生石灰,气体用P2O5干燥
参考答案:C
本题解析:
正确答案:C
A、得不到氨气,生成HCl气体;
B、是工业制氨气;
C、正确;
D、不能用酸性干燥剂。
本题难度:简单
|