|
|
|
高中化学知识点归纳《水的电离平衡》考点巩固(2020年最新版)(六)
2021-02-18 06:46:58
【 大 中 小】
|
1、选择题 在水中加入下列粒子,不破坏水的电离平衡的是
[? ]
A.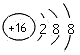
B.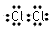
C.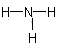
D.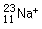
参考答案:D
本题解析:
本题难度:一般
2、选择题 下列叙述正确的是
A.把纯水加热,水的电离程度增大,但水仍然是中性的,pH=7
B.在醋酸溶液中加入少量的CH3COONa(s),测得pH变大,主要原因是CH3COONa水解呈碱性,中和醋酸电离的H+
C.pH=3的醋酸溶液,稀释至10倍后pH<4
D.相同浓度的CH3COONa溶液与Na2CO3溶液相比,Na2CO3溶液的pH小
|
参考答案:C
本题解析:水的电离是吸热过程,升高温度,促进水的电离,但c(OH-)=c(H+),水仍然呈中性,但pH减小,A错误;CH3COOH CH3COO-+H+,向醋酸溶液中加入醋酸钠固体,c(CH3COO-)增大,平衡向左移动,c(H+)减小,pH增大,B错误;pH=3的醋酸中c(H+)=10-3mol/L,稀释至10倍后,CH3COOH继续电离补充H+,所以c(H+)>10-4mol/L,pH<4,C正确;酸性CH3COOH>H2CO3>HCO3-,所以同浓度溶液的碱性:Na2CO3>CH3COONa,D错误。 CH3COO-+H+,向醋酸溶液中加入醋酸钠固体,c(CH3COO-)增大,平衡向左移动,c(H+)减小,pH增大,B错误;pH=3的醋酸中c(H+)=10-3mol/L,稀释至10倍后,CH3COOH继续电离补充H+,所以c(H+)>10-4mol/L,pH<4,C正确;酸性CH3COOH>H2CO3>HCO3-,所以同浓度溶液的碱性:Na2CO3>CH3COONa,D错误。
考点:水的电离 弱电解质的电离平衡 溶液的稀释与pH 盐类的水解
点评:pH相同的弱酸与强酸稀释相同的倍数后,强酸pH变化大,因稀释过程中弱酸继续电离补充H+。同理,pH相同的强碱与弱碱稀释相同的倍数后,强碱pH变化大。
本题难度:困难
3、选择题 下列说法正确的是( ? )
A.在温度不变时,水溶液中c(H+)和c(OH-)不能同时增大
B.pH=0的溶液是酸性最强的溶液
C.强酸的水溶液中不存在OH-
D.某温度下,纯水中c(H+)=2×10-7mol?L-1,其呈酸性
参考答案:A
本题解析:
本题难度:简单
4、填空题 27.(10分)下图为某加碘盐标签的一部分。

已知:①KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O
②I2+2Na2S2O3=2NaI+Na2S4O6(无色)
某同学想定量测定此加碘盐中碘元素的含量,进行以下实验:
步骤1:称取ag市售食盐,配成溶液,全部转移至锥形瓶中,
加入适量新制KI溶液,滴入几滴稀硫酸,溶液变黄色,再加入3滴淀粉溶液。
步骤2:取一支50mL碱式滴定管,用bmol·L-1的新制Na2S2O3 溶液润洗2~3次后,装满溶液,调节液面高度至0刻度。
步骤3:开始滴定直至终点,重复操作2~3次,实验数据记录如下:
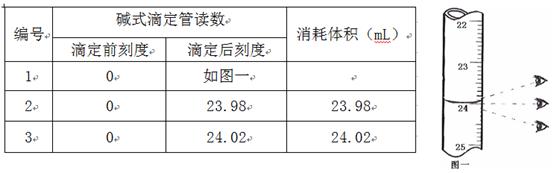
(1)第一次读数为 mL。
(2)滴定终点的判断方法 。
(3)经过计算,此碘盐碘元素的含量为 mg·kg-1(用含a、b的最简表达式表示) 。
(4)下列操作可能会导致测量结果偏低的是 。
A.步骤1中称取食盐时将砝码放在左盘,食盐放在放在右盘,游码读数为0.5g
B.步骤1所配食盐溶液未完全转移至锥形瓶
C.步骤2中滴定管洗涤后未润洗
D.步骤3滴定前滴定管尖嘴处有气泡,滴定后气泡消失
|
(5)请在答题纸的方框内画出正在排气泡的碱式滴定管(仅画出刻度以下部分)
参考答案:(1)24.00
(2)溶液颜色恰好由蓝色变为无色且半分钟内不变色(不变蓝)
(3)508000b/a(或5.08×105b/a)
(4)AB
(5)
本题解析:正确读取读数,目光平视,刻度为24.00ml;滴定终点的判断,当变色稳定,半分钟不变色时说明达到滴定重点;碘盐碘点元素的含量用碘酸钾的质量与碘元素的质量分数相乘,逐步计算ω=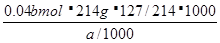 =508000b/a;滴定时滴定管未润洗,结果偏大;滴定管尖嘴处有气泡,体积读数变大,结果偏大。
=508000b/a;滴定时滴定管未润洗,结果偏大;滴定管尖嘴处有气泡,体积读数变大,结果偏大。
考点:滴定原理及应用
点评:要掌握酸碱滴定的基本步骤,扩展到普通滴定,会进行误差的分析,正确判断滴定的终点。
本题难度:困难
5、选择题 一定温度下,满足下列条件的溶液一定呈酸性的是
A.能与金属Al反应放出H2的溶液
B.加酚酞后显无色的溶液
C.pH=6的溶液
D.c(H+)>c(OH-)的任意水溶液
参考答案:D
本题解析:A、金属铝能和酸反应也能和碱反应生成氢气,所以不选A;B、加入酚酞后显无色的溶液也可能是中性的或弱碱性的,所以不选B;C、没有说明溶液的温度,不能确定溶液中氢离子和氢氧根离子浓度之间的关系,不选C;D、当氢离子浓度大于氢氧根离子浓度时,溶液显酸性,选D。
考点:溶液的酸碱性。
本题难度:一般

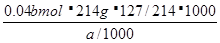 =508000b/a;滴定时滴定管未润洗,结果偏大;滴定管尖嘴处有气泡,体积读数变大,结果偏大。
=508000b/a;滴定时滴定管未润洗,结果偏大;滴定管尖嘴处有气泡,体积读数变大,结果偏大。