1、填空题 (本题共8分)
白磷(P4)是一种常见的晶体,可用于制备较纯的磷酸。根据题意回答:
1.31g白磷与足量的氧气完全燃烧生成P2O5固体,释放出745.5 kJ的热量,请写出白磷燃烧的热化学反应方程式:?;
2.完成并配平白磷和氯酸溶液反应的化学方程式:
?P4 + ?HClO3 + ????→ ?HCl + ?H3PO4
3.白磷有毒,在实验室可采用CuSO4溶液进行处理,其反应为:
11P4 + 60CuSO4 + 96H2O → 20Cu3P + 24H3PO4 + 60H2SO4
该反应的氧化产物是?,若有1.1 mol P4反应,则有?mol电子转移。
4.磷的一种化合物叫亚磷酸(H3PO3)。已知:⑴0.1 mol/L H3PO3溶液的pH = 1.7;⑵H3PO3与NaOH反应只生成Na2HPO3和NaH2PO3两种盐;⑶H3PO3和碘水反应,碘水棕黄色褪去,再加AgNO3有黄色沉淀生成。关于H3PO3的说法:①强酸;②弱酸;③二元酸;④三元酸;⑤氧化性酸;⑥还原性酸,其中正确的是?.
A.②④⑥
B.②③⑥
C.①④⑤
D.②③⑤
参考答案:(共8分)
1、P4(s) + 5O2(g) → 2P2O5(s) △H= — 2982 kJ/mol(2分)
2、3,10,18H2O,10,12(2分)
3、H3PO4(1分)? 12(1分)
4、B(2分)
本题解析:1、由题意可求得1 mol P4与氧气完全燃烧放出的热量为2982 kJ
2、根据化合价的升降可知反应中的60e—转移,反应物中加“水”才可配平
3、从方程式可看出,部分P化合价升高为+5,氧化产物为磷酸;电子转移为120e—
4、0.1 mol/L H3PO3溶液的pH = 1.7>1,说明为部分电离,为弱酸;和碱液中和只能生成两种酸式盐,则它为二元酸;和碘水反应,碘水棕黄色褪去,再加AgNO3有黄色沉淀生成,说明碘被还原为碘离子,有AgI黄色沉淀生成,也就是说H3PO3为还原性酸。
本题难度:一般
2、填空题 在一定条件下,某元素的氢化物X可完全分解为两种单质Y和Z。若已知:
①反应前的X与反应后生成的Z的物质的量之比n(X)∶n(Z)=2∶3。
②单质Y的分子为正四面体构型。
请填写下列空白。
(1)单质Y是______________,单质Z是_________________(填写名称或化学式)。
(2)Y分子中共含________________个共价键。
(3)X分解为Y和Z的化学方程式为:____________________________________。
参考答案:(1)P4? H2(2)6
(3)4PH3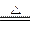 P4+6H2
P4+6H2
本题解析:本题是一道推断题,解题关键是找出“突破口”,该题的突破口是单质Y的分子为正四面体构型。根据Y分子为正四面体构型,假设Y为P4,可推测X为PH3。
4PH3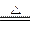 P4+6H2
P4+6H2
即n(X)∶n(Z)=2∶3
本题难度:简单
3、填空题 A、B、C、D、E是五种中学化学常见的单质,已知A、B、C、D在常温下均为气态。其中D能分别跟A、B、C在一定条件下两两化合,生成化合物X、Y、Z;A与B、C均不能直接化合。有关的转化关系如下图所示(反应条件均已略去)。
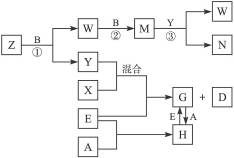
完成下列问题:
(1)Z分子的空间构型为_________。
(2)反应③中被氧化的物质与被还原物质的物质的量之比为_________。
(3)Z和W在催化剂作用下,反应生成C和Y,这是一个很有实际意义的反应,可以消除W对环境的污染,该反应的化学方程式为___________________________。
(4)将过量的E加到N的稀溶液中,若过程中转移电子的数目为3.01×1023个,则参加反应的E的质量为_________g。
(5)将Z与N反应后的产物溶于水中,则溶液的pH_________(填“<”或“>”)7,其原因是(用离子方程式表示)_________________。
参考答案:(1)三角锥形 ?(2)2∶1
(3)4NH3+6NO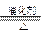 5N2+6H2O
5N2+6H2O
(4)14
(5)<?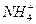 +H2O
+H2O NH3·H2O+H+
NH3·H2O+H+
本题解析:A、B、C、D在常温下是气体单质,常见的气体单质只有H2、N2、O2、F2、Cl2五种,其中D能分别跟A、B、C在一定条件下两两化合,可推出D为H2,那么对应的氢化物可为NH3、H2O、HF(或者HCl)。由Y+X+E G+H2,可知E为金属,又因为G
G+H2,可知E为金属,又因为G H,所以E为变价金属Fe,那么Y+X应为常见的盐酸,那么A为Cl2,X为HCl,C为N2,Z为NH3,空间构型为三角锥形。B为O2,Y为H2O,W为NO,M为NO2,NO2+H2O====2HNO3+NO,所以被氧化的物质与被还原物质的物质的量之比为2∶1。过量的Fe和HNO3反应生成Fe2+,所以参加反应的Fe为0.25 mol,即为14 g。Z与N反应后的产物为NH4NO3溶液,溶液显酸性的原因是:
H,所以E为变价金属Fe,那么Y+X应为常见的盐酸,那么A为Cl2,X为HCl,C为N2,Z为NH3,空间构型为三角锥形。B为O2,Y为H2O,W为NO,M为NO2,NO2+H2O====2HNO3+NO,所以被氧化的物质与被还原物质的物质的量之比为2∶1。过量的Fe和HNO3反应生成Fe2+,所以参加反应的Fe为0.25 mol,即为14 g。Z与N反应后的产物为NH4NO3溶液,溶液显酸性的原因是: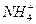 +H2O
+H2O NH3·H2O+H+。
NH3·H2O+H+。
本题难度:简单
4、填空题 (6分)下列事实反映了硝酸的什么性质:①不稳定性②强氧化性③强酸性
⑴硝酸应贮存在棕色试剂瓶中 ;⑵Ag与稀硝酸作用制取AgNO3 ;⑶可用稀硝酸与CaCO3作用制取CO2。
参考答案:⑴.① ⑵②③⑶③
本题解析:略
本题难度:简单
5、填空题 (10分)某研究性学习小组研究HNO3的氧化性,设计了如下实验:在盛有新配制的FeSO4溶液的试管中滴入2滴KSCN溶液,观察现象,然后再加入浓HNO3,溶液的颜色变红,但是将红色溶液放置一会儿则发现溶液由红色快速变为蓝色,并产生红棕色气体,这一奇特现象激起了同学们的好奇心与求知欲望,他们对此现象设计了探究性实验。
(1)甲同学认为是溶液中的Fe2+的干扰造成的,大家经过理性分析,认为可以排除Fe2+的干扰,理由是 ? ? 。
(2)乙同学认为红色消失,说明Fe(SCN)3被破坏,红棕色NO2说明了某些离子与HNO3发生了氧化还原反应,推测可能是KSCN与HNO3作用。根据C、S、N的原子结构和共价键的相关知识推断SCN-的结构式为?。
(3)根据乙同学的,观点,设计了实验方案1,往浓HNO3中逐滴加入KSCN溶液,实验开始时无明显现象,一段时间后溶液慢慢变红色至深红色 ,突然剧烈反应产生大量气泡,放出红棕色气体,而溶液红色消失变为浅绿色,溶液温度升高;继续滴入KSCN溶液变为浅蓝色,最后变为无色。将产生的气体通入过量的Ba(OH)2溶液,产生浑浊,并剩余一种非极性气体;向反应后的溶液中加入BaCl2溶液产生白色沉淀。(此过程中溶液颜色变化不必细究),请写出向浓HNO3中滴入KSCN离子的方程式:?。
,突然剧烈反应产生大量气泡,放出红棕色气体,而溶液红色消失变为浅绿色,溶液温度升高;继续滴入KSCN溶液变为浅蓝色,最后变为无色。将产生的气体通入过量的Ba(OH)2溶液,产生浑浊,并剩余一种非极性气体;向反应后的溶液中加入BaCl2溶液产生白色沉淀。(此过程中溶液颜色变化不必细究),请写出向浓HNO3中滴入KSCN离子的方程式:?。
(4)丙同学认为SCN-的性质 还可进一步探究,设计了方案2,向Fe(SCN)3中分别滴加过量的氯水.溴水,溶液的红色均消失变为黄色,而加入过量的碘水时溶液的颜色基本不变。丙同学的设计意图是?。
(5)通过本次探究,可知用SCN-间接检验Fe2+时应注意?。
参考答案:

本题解析:略
本题难度:一般