1、选择题 在溶液中能共存,加入OH-有沉淀析出,加入H+能放出气体的是
A.Na+、H+、NO3-、Cl-
B.K+、H+、Cl-、SO42-
C.Ca2+、NO3-、HCO3-、Cl-
D.Fe3+、NH4+、SCN-、Cl
参考答案:C
本题解析:分析:OH-有沉淀析出,可能为氢氧化物沉淀或存在酸式盐的酸根离子,加入碱后生成沉淀,加入H+能放出气体,说明溶液中存在HCO3-或CO32-,根据离子的性质作进一步判断.
解答:A、该组离子能共存,但加入OH-没有沉淀析出,加入H+不能放出气体,故A错误;
B、该组离子能共存,但加入OH-没有沉淀析出,加入H+不能放出气体,故B错误;
C、该组离子能共存,加入OH-有CaCO3沉淀析出,加入H+能放出CO2气体,故C正确;
D、该组离子中Fe3+与SCN-发生络合反应而不能大量共存,故D错误.
故选C.
点评:本题考查离子共存问题,题目难度不大,注意题目要求,掌握有关基础知识.
本题难度:困难
2、选择题 下列说法正确的是
A.在化学反应中某元素由化合态变为游离态,该元素一定是被还原
B.失电子难的原子获得电子的能力一定强
C.电子层结构相同的各种离子,它的半径随核电荷数的增加而减少
D.最外层电子数少的金属元素,一定比最外层电子数较它多的金属元素活泼性较强
参考答案:C
本题解析:选项A不正确。在化学反应中,若元素以阳离子或正价形式存在变为中性原子(游离态)时,是被还原了。但若元素以阴离子形式存在转变为中性原子时,则该元素却是被氧化了。例如:

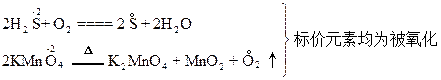
选项B不正确。失电子难的原子,在多数情况下变成离子后得电子就容易些,例如Cu比Zn难失电子,则Cu2+比Zn2+易得电子;失电子难的非金属原子,一般地说,其原子得电子就较容易些,如F比Cl难失电子,则F比Cl易得电子。但若对稀有气体来说,由于其原子的最外层已达到8个电子的稳定结构,所以它既不易得电子,也不易失去电子。故选项B未必正确。
选项C正确。“电子层结构相同”是指电子层数和各层电子数均相同,所以此时离子的半径只取决于核电荷数的多少,核电荷数越多,即核所带的正电荷越多,对核外电子的吸引力越强,所以半径越小。故选项C一定正确。
选项D未必正确。对于金属元素而言,它的活泼性强弱主要取决于元素原子失电子能力的大小,而金属原子失电子能力的大小,除了跟最外层电子数多少有关外(一般来说,最外层电子数越少,越容易失电子),还跟金属原子核外电子层结构有关,即与电子层数也有关。层数越多,一般失电子能力越强。所以D未必正确。
本题难度:简单
3、选择题 在20世纪末期,科学家发现并证明碳有新的单质形态C60存在。后来人们又相继得到了C70、C76、C84、C90、C94等另外一些球碳分子。21世纪初,科学家又发现了管状碳分子和洋葱状碳分子,大大丰富了碳元素单质的家族。
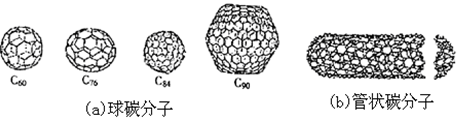
下列有关碳元素单质的说法错误的是
A.金刚石的熔点肯定要比C60高
B.金刚石的硬度肯定要比C60大
C.球碳分子,管状碳分子、洋葱状碳分子,都是分子晶体,都是碳的同素异形体
D.金刚石属原子晶体,管状碳分子属分子晶体,它们不是同素异形体。
参考答案:D
本题解析:考点:同素异形体.
专题:物质的分类专题.
分析:根据同素异形体是同种元素形成的不同单质来解答.
解答:解:A、碳有新的单质形态C60、C70、C76、C84、C90、C94等,是分子晶体,而金刚石是原子晶体,所以熔点比金刚石低,故A错误;
B、球碳分子、管状碳分子均属于分子晶体,故B错误;
C、球碳分子、管状碳分子是单质,同分异构体是分子式相同但结构不同的化合物,故C错误;
D、球碳分子、管状碳分子都是碳元素形成的不同单质,所以互为同素异形体,而不是同分异构体,故D正确;
故选D.
点评:本题考查同素异形体的有关知识,要正确理解碳有新的单质形态C60、C70、C76、C84、C90、C94等一些球碳分子和管状碳分子都是碳元素的单质.
本题难度:一般
4、选择题 在某密闭容器中通入a mol NO和b mol O2,发生反应:2NO+O2=2NO2,反应后容器内氮原子和氧原子之比为
A.a:b
B.a:(a+2b)
C.a:2b
D.a:2(a+b)
参考答案:B
本题解析:分析:根据原子守恒:化学反应前后原子总数不变(不管如何反应,以及反应是否完全)来回答.
解答:反应前N原子总数是amol(全部在NO中),O原子总数是(a+2b)mol(NO中有O原子,O2中也有O原子),根据原子守恒:反应后原子个数不变,所以氮原子和氧原子个数之比=a:(a+2b).
故选B.
点评:本题考查学生原子守恒思想在反应中的应用知识,较简单.
本题难度:简单
5、选择题 下列溶液中,一定能大量共存的微粒组是
A.pH=1的溶液中:K+、Cr2O72-、CH3CH2OH、SO42-
B.澄清透明溶液:Cr2O7-、SO42-、K+、NO3-
C.使pH试纸呈红色的溶液:Na+、[Al(OH)4]-、SO42-、CI-
D.c(H+)/c(OH-)=1012的溶液中:Na+、C2O42-、Fe3+、NO2-
参考答案:B
本题解析:分析:A.离子之间发生氧化还原反应;
B.该组离子之间不反应;
C.使pH试纸呈红色的溶液,显酸性;
D.c(H+)/c(OH-)=1012的溶液,c(H+)=0.1mol/L,溶液显酸性.
解答:A.pH=1的溶液中H+、Cr2O72-、CH3CH2OH发生氧化还原反应,则不能共存,故A错误;
B.该组离子之间不反应,则能够大量共存,故B正确;
C.使pH试纸呈红色的溶液,显酸性,H+、[Al(OH)4]-结合生成沉淀,则不能共存,故C错误;
D.c(H+)/c(OH-)=1012的溶液,c(H+)=0.1mol/L,溶液显酸性,H+、C2O42-结合生成弱酸,且C2O42-、Fe3+发生氧化还原反应,则不能共存,故D错误;
故选B.
点评:本题考查离子的共存,明确习题中的信息是解答本题的关键,注意离子之间的氧化还原反应,选项D为解答的难点,题目难度中等.
本题难度:一般