1、选择题
 ?
?
A?.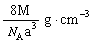 ? B.?
? B.?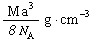 ?
?
C.?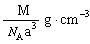 ? D.?
? D.?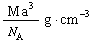
参考答案:C
本题解析:解法一:晶体的密度等于晶体的质量与晶体在该质量下的体积的比值(即晶体的密度= ),据式量可知,1 mol CsCl的质量为M克,故需求出1mol CsCl的体积。因晶体是由晶胞构成的,而1个CsCl晶胞的体积为a3?cm3。因此,此题解题的关键是找出1 mol CsCl晶体中的晶胞数目,由晶胞的示意图可知,1个晶胞中含1个Cs+和1个Clˉ,所以,在1 mol CsCl晶体中含NA个的晶胞。由此可得,晶体的密度为
),据式量可知,1 mol CsCl的质量为M克,故需求出1mol CsCl的体积。因晶体是由晶胞构成的,而1个CsCl晶胞的体积为a3?cm3。因此,此题解题的关键是找出1 mol CsCl晶体中的晶胞数目,由晶胞的示意图可知,1个晶胞中含1个Cs+和1个Clˉ,所以,在1 mol CsCl晶体中含NA个的晶胞。由此可得,晶体的密度为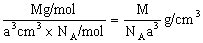 。
。
解法二:一个晶胞的体积为a3?cm3,若求出一个晶胞的质量,则可以求出晶胞的密度,也就是晶体的密度(因为晶胞是晶体中最小的结构单元)。根据晶胞的结构示意图可知,1个晶胞中含1个Cs+和1个Clˉ,所以一个晶胞的质量也就是1个Cs+和1个Clˉ的质量,所以晶胞的质量为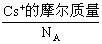 +
+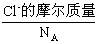 ,即
,即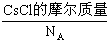 =
= ,因此也可得出晶体的密度。
,因此也可得出晶体的密度。
本题难度:一般
2、选择题 硒有两种同素异形体:灰硒和红硒。灰硒溶于氯仿(CHCl3),红硒溶于二硫化碳,它们都不溶于水,则灰硒和红硒的晶体属于
A.原子晶体
B.分子晶体
C.金属晶体
D.离子晶体
参考答案:B
本题解析:氯仿是极性分子,二硫化碳是非极性分子,所以根据相似相溶原理可知,灰锡是极性分子,红锡是非极性分子,二者形成的晶体都是分子晶体,答案选B。
点评:离子间通过离子键形成的晶体是离子晶体,分子间通过分子间作用力形成的晶体是分子晶体,原子间通过共价键形成的空间网状结构的晶体是原子晶体,由金属阳离子和自由电子构成的晶体是金属晶体。
本题难度:一般
3、填空题 (5分)有一种蓝色晶体,它的结构特征是Fe2+和Fe3+分别占据立方体互不相邻的顶点,而CN— 离子位于立方体的棱上。
(1)根据晶体结构特点,推出其化学式(用最简单整数示)______________ __。
(2)此粒子带何种电荷?用什么样的离子可与其结合成电中性的物质?写出此电中性物质的化学式(用M+表示)。?
(3)指出(2)中添加离子在晶体结构中的什么位置?
参考答案:(5分,各1分)(1) [FeFe(CN)6] -?
(2)带一个单位负电荷?可用Na+、K+、Rb+与之结合? MFeFe(CN)6? (3)M+在每一个立方体的体心上。
本题解析:(1)Fe2+、Fe3+占据立方体的互不相邻的顶点,则每个立方体上有4个Fe2+、4个Fe3+,根据晶体的空间结构特点,每个顶点上的粒子有1/8属于该立方体,则该立方体中有1/2个Fe2+、1/2个Fe3+,CN-位于立方体的棱上,棱上的微粒有1/4属于该立方体,该立方体中有3个CN-,所以该晶体的化学式为[FeFe(CN)6]-。
(2)此化学式带负电荷,所以应该均和阳离子才能成为电中性的物质。若结合M+形成中性粒子,此微粒化学式为MFeFe(CN)6。
(3)由于M+离子在晶胞中含有1个,所以在晶胞中的位置应该是在每一个立方体的体心上。
点评:该题是中等难度的试题,试题综合性强,比较抽象。有利于培养学生的逻辑推理能力和抽象思维能力。该题的关键是明确晶胞中离子个数的计算原则和依据,有利于培养学生的应试能力,提高学生分析问题、解决问题的能力。
本题难度:一般
4、选择题
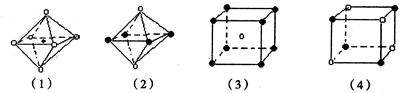
A.图(1)和图(3)
B.图(2)和图(3)
C.图(1)和图(4)
D.只有图(4)
参考答案:C
本题解析:本题考查了离子晶体的代表NaCl 、CsCl晶体结构。NaCl晶体是简单立方体结构,每个Na+周围有6个Cl-,每个Cl-周围有6个Na+;与每个Na+等距的Cl-有6个且6个Cl-构成正八面体,同理,与每个Cl-等距的6个Na+也构成正八面体;由此可知,图(1)和图(4)是属于NaCl 晶体的。
本题难度:一般
5、选择题 下列指定粒子的个数比为2∶1的是( )
A.Be2+中的电子和质子
B.Na2O2中的阳离子和阴离子
C.NaHCO3晶体中的阳离子和阴离子
D.BaO2(过氧化钡)固体中的阴离子和阳离子
参考答案:B
本题解析:Be2+中的电子数为2质子为4,所以为1:2,Na2O2中有Na+和O22-个数比为2:1,NaHCO3晶体中Na+和HCO3-个数比为1:1,BaO2(过氧化钡)固体中Ba2+和O22-个数比为1:1。答案选B。
点评:本题要注意过氧化物中的阴离子是O22-。
本题难度:一般