1、选择题 在标准状况下,与22.4LH2体积相等的N2的( )
A.质量为14g
B.质量为7g
C.物质的量为1mol
D.物质的量为2mol
参考答案:标准状况下,与22.4LH2体积相等的N2,其物质的量相等,均为22.4L22.4L/mol=1mol,
A.氮气的质量为1mol×28g/mol=28g,故A错误;
B.氮气的质量为1mol×28g/mol=28g,故B错误;
C.由上述分析可知,物质的量为1mol,故C正确;
D.由上述分析可知,物质的量为1mol,故D错误;
故选C.
本题解析:
本题难度:简单
2、实验题 若配制500 mL 0.2 mol/L的稀硫酸
(1)需要量取质量分数为98%的硫酸(密度为1.84 g·mL-1)_____________mL。
(2)下面是某学生的操作过程:
a.检查容量瓶是否漏水;
b.用100 mL的量筒量取浓硫酸;
c.将浓硫酸倒入另一个盛有适量蒸馏水的量筒中稀释,并冷却到室温;
d.用玻璃棒引流,将稀释后的硫酸倒入500 mL的容量瓶;
e.轻轻摇动容量瓶,使瓶内液体混合均匀,再向容量瓶中加水至离刻度线1 cm~2 cm;
f.用胶头滴管加水至凹液面底部与刻度线相切,摇匀;
g.在容量瓶上贴上标签待用。
按照通常的配制要求,指出其中缺少或操作的错误,并补充或改正(有几项填几项,若空格不够可以补加)。
①_________________________________;
②_________________________________;
③_________________________________;
④_________________________________;
⑤_________________________________。
(3)任何实验都有误差,在你改正后的操作中,产生误差的原因还有_________________。
(4)本实验最浪费时间的步骤是将稀释后的硫酸冷却到室温,为了节约时间,简便易行的加快稀硫酸冷却的方法是______________________________________。
参考答案:(1)5.4
(2)①缺少洗涤烧杯和玻璃棒的操作;②量筒的规格错,应该用10mL的量筒量取浓H2SO4(或用移液管、酸式滴定管量取浓H2SO4);③不应该在量筒中稀释浓H2SO4,应用烧杯;④不应该用容量瓶保存溶液,应用细口瓶
(3)量筒的精确度不够高(或读数误差,溶质仍有少量残留在烧杯内、室温未必是20℃等)(答案合理即可)
(4)充分搅拌(给盛有稀H2SO4的烧杯敷冰块等)(答案合理即可)
本题解析:
本题难度:一般
3、选择题 现有一氢氧化钡和氢氧化钠的混合溶液,往溶液中持续不断缓慢通入CO2气体,当通入a g CO2时生成的沉淀量达到最大值,当通入b g CO2时沉淀恰好完全溶解,则原溶液中氢氧化钡与氢氧化钠的物质的量浓度之比为
A.a︰(b-a)
B.a︰(b-2a)
C.a︰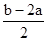
D.a︰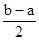
参考答案:B
本题解析:假定原溶液中Ba(OH)2为x mol,NaOH为y mol
沉淀量最大时:Ba(OH)2+CO2=BaCO3↓+H2O
x mol? a g
沉淀全部溶解时:OH-?+? CO2?=? HCO3-
2x+y mol?b g
解得: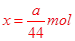 ?
?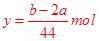
本题难度:一般
4、选择题 物质的量浓度相同的NaCl、MgCl2、AlCl3三种溶液,当溶液的体积比为3∶2∶1时,三种溶液中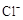 的物质的量浓度之比为 (? )
的物质的量浓度之比为 (? )
A.1∶2∶3
B.1∶1∶1
C.3∶2∶1
D.3∶4∶3
参考答案:A
本题解析:根据氯化物的化学式可知,溶液中氯离子的浓度之比是1∶2∶3,而与溶液的体积无关系,答案选A。
点评:该题是基础性试题的考查,难度不大。试题注重基础,兼顾能力的培养。该题的关键是明确构成物质的离子以及相应的电离情况,另外还需要注意的是计算的浓度还是离子的物质的量,有利于培养学生的灵活应变能力。
本题难度:简单
5、选择题 关于SO2的叙述中,正确的是
[? ]
A.SO2的摩尔质量是64g
B.1molSO2中所含分子数约为6.02×1023
C.1molSO2的质量是64g / mol
D.常温常压下,1molSO2的体积为22.4L
参考答案:B
本题解析:
本题难度:简单