1、选择题 下列溶液跟100mL0.5mol?L-1NaCl溶液所含Cl-物质的量浓度相同的是( )
A.100mL?0.5?mol?L-1MgCl2溶液
B.200mL?0.5?mol?L-1CaCl2溶液
C.25?mL?0.5?mol?L-1HCl溶液
D.50?mL 1?mol?L-1KCl溶液
参考答案:100mL0.5mol?L-1NaCl溶液所含Cl-物质的量浓度为0.5mol?L-1
A、100mL?0.5?mol?L-1MgCl2溶液氯离子浓度为0.5?mol/L×2=1mol/L,故A错误;
B、200mL?0.5?mol?L-1CaCl2溶液氯离子浓度为0.5mol/L×2=1mol/L,故B错误;
C、25?mL?0.5?mol?L-1HCl溶液氯离子浓度为0.5mol/L,故C正确;
D、50?mL 1?mol?L-1KCl溶液氯离子浓度为1mol/L,故D错误;
故选:C.
本题解析:
本题难度:简单
2、填空题 (选做题12分)
以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略):
Ⅰ.从废液中提纯并结晶出FeSO4·7H2O。
Ⅱ.将FeSO4·7H2O配制成溶液。
Ⅲ.FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeC03的浊液。
Ⅳ.将浊液过滤,用90℃热水洗涤沉淀,干燥后得到FeC03固体。
参考答案:
本题解析:
本题难度:困难
3、选择题 多少mol CaCl2溶解在1mol水中,才使Cl-与H2O分子的物质的量之比为1:10( )
A.0.1mol
B.10mol
C.0.5mol
D.0.05mol
参考答案:溶液中Cl-与H2O分子的物质的量之比为1:10,则n(Cl-)=1mol10=0.1mol,
CaCl2完全电离,由氯离子守恒n(Cl-)=2n(CaCl2)=0.1mol,故n(CaCl2)=0.05mol,
故选D.
本题解析:
本题难度:一般
4、填空题 设NA表示阿伏加德罗常数的数值,其计算近似值为6.02×1023。按要求完成下列填空:
(1)1 mol Cl2中含有 个氯气分子,约含有 个氯原子。
(2)0.5 mol NH3中含有 个氨分子,共约含有 个原子。
(3)3 mol NO和 mol NO2所含有的原子数相等。
(4)6mol H2O与 mol NH3所含氢子数相等。
(5)某硫酸钠溶液中含有3.01×1022个Na+,则该溶液中SO42-的物质的量是 。
(6)1.204×1024个水分子的物质的量是 。1molH2SO4中氧原子数为 。
(7)1molMgCl2中氯离子数为 ,离子总数约为 。
(8)1mol CuSO4·5H2O含有 个Cu2+,含有_____mol水分子。
(9)2molCO(NH2)2中含 mol碳原子, mol氧原子, mol氮原子, ___mol氢原子。
参考答案:(1) 6.02×1023, 1.204×1024。 (2) 3.01×1023, 1.204×1024。
(3)2。 (4)4。 (5)0.025 mol。 (6) 2mol。2.408×1024。
(7) 1.204×1024, 1.806×1024。 (8) 6.02×1023, 5。 (9) 2mol,2mol,4mol,8mol。
本题解析:(1)1 mol Cl2中含有6.02×1023个氯气分子,约含有2×6.02×1023= 1.204×1024;(2)0.5 mol NH3中含有0.5×6.02×1023= 3.01×1023,共约含有4×0.5×6.02×1023= 1.204×1024;(3)3 mol NO和2molNO2所含有的原子数相等;(4)6mol H2O含有12mol的氢原子,与4mol NH3所含氢子数相等;(5)某硫酸钠溶液中含有3.01×1022个Na+,则该溶液中SO42-的物质的量=3.01×1022/6.02×1023×0.5=0.025mol;(6)1.204×1024个水分子的物质的量1.204×1024/6.02×1023=2mol,1molH2SO4中氧原子数=6.02×1023×4=2.408×1024;1molMgCl2中氯离子数为6.02×1023×2=1.204×1024,离子总数=6.02×1023×3=1.806×1024;(8)1mol CuSO4·5H2O含有6.02×1023个Cu2+,含有的水分子数目为5mol;(9)2molCO(NH2)2中含有的碳原子为2mol,氧原子为2mol,氮原子为4mol,氢原子为8mol。
考点:阿伏加德罗常数、物质的量
点评:本题考查了阿伏加德罗常数、物质的量的相关计算,该题比较基础,注意运算的正确性,本题不难。
本题难度:一般
5、选择题 将0.8 mol·L-1 BaCl2溶液10 mL与1 mol·L-1 AgNO3溶液10 mL充分混合,滤去难溶物,在滤液中滴加CuSO4溶液,将出现的现象是()
A.有蓝色沉淀生成
B.无沉淀生成
C.有白色沉淀AgCl生成
D.有白色沉淀BaSO4生成
参考答案:D
本题解析:BaCl2+2AgNO3 Ba(NO3)2+2AgCl↓
Ba(NO3)2+2AgCl↓
8×10-3 mol? 10×10-3 mol
离子方程式为:Cl-+Ag+ AgCl↓,则滤液中含有Ba2+、
AgCl↓,则滤液中含有Ba2+、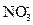 ,剩余Cl-,当向滤液中滴加CuSO4溶液时,Ba2++
,剩余Cl-,当向滤液中滴加CuSO4溶液时,Ba2++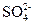
 BaSO4↓,故选D。
BaSO4↓,故选D。
本题难度:简单