|
高考化学知识点整理《认识晶体》高频考点巩固(2020年模拟版)(十)
2021-02-18 07:05:00
【 大 中 小】
|
1、填空题 (8分)、氮化硅是一种高温陶瓷材料,它的硬度大、熔点高、化学性质稳定。工业上普遍采用高纯硅与纯氮在1300℃反应获得氮化硅。
(1)根据性质,推测氮化硅属于________晶体。
(2)根据性质,推测氮化硅陶瓷的用途是_________(填序号)。
A.制汽轮机叶片
B.制有色玻璃
C.制永久性模具
D.制造柴油机
| (3)根据化合价规律,推测氮化硅的化学式为_________。
(4)氮化硅陶瓷抗腐蚀性强,除氢氟酸外,它不与其他无机酸反应。试写出该陶瓷被氢氟酸腐蚀的化学方程式_______________________________________。
参考答案:(1)原子晶体(1分)?(2)A、C、D (3分)?(3)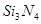 ?(2分)? ?(2分)?
(4)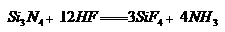 (2分) (2分)
本题解析:(1)硬度大、熔点高、化学性质稳定,符合原子晶体的性质,即氮化硅是原子晶体。
(2)根据氮化硅的性质可判断,不应该用来制作有色玻璃,其余选项都是正确的。答案选ACD。
(3)氮的非金属性强于硅的,化合价-3价,硅是ⅣA,化合价是+4价,所以化学式为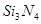 。 。
(4)根据氮化硅中氮和硅的化合价可判断,生成物是四氟化硅和氨气,方程式为
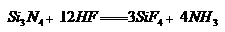 。 。
本题难度:一般
2、选择题 下列说法中正确的是(? )
A.金刚石晶体中的最小碳原子环由6个碳原子构成
B.Na2O2晶体中阴离子与阳离子数目之比为1∶1
C.1 mol SiO2晶体中含2 mol Si—O键
D.金刚石化学性质稳定,即使在高温下也不会和O2反应
参考答案:A
本题解析:Na2O2的电子式为Na+[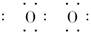 ]2-Na+, ]2-Na+,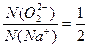 ,B错误;1 mol SiO2晶体中有4 mol Si—O键,C错误;金刚石高温下可与O2反应生成CO2,D错误。 ,B错误;1 mol SiO2晶体中有4 mol Si—O键,C错误;金刚石高温下可与O2反应生成CO2,D错误。
本题难度:一般
3、填空题 (10分)已知有关物质的熔、沸点数据如下表:
?
| MgO
| Al2O3
| MgCl2
| AlCl3
| 熔点(℃)
| 2852
| 2045
| 714
| 190(2.5×105Pa)
| 沸点(℃)
| 3600
| 2980
| 1412
| 177.8
|
(1)工业上常用电解熔融MgCl2的方法生产金属镁;用电解Al2O3与冰晶石熔融混合物的方法生产铝。不用电解MgO的方法生产镁的原因是:___▲____; AlCl3可能为___▲____晶体。
(2)请设计可靠的实验证明MgCl2、AlCl3所属化合物的类型,其实验方法是_____▲____ 。
(3)AlCl3具有以下__▲__特殊性质(请填序号)。①液化②挥发③升华
参考答案:共10分
(1)MgO的熔点很高,很难熔融(2分)?分子(2分)
(2)分别将它们在一定条件下熔融,再进行导电实验,能导电的是离子化合物,不能导电的是共价化合物(3分)
(3)③(3分)
本题解析:略
本题难度:一般
4、简答题 已知A、B、C、D、E都是元素周期表中前36号的元素,其原子序数依次增大.A与其他4种元素既不在同一周期又不在同一族.B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第8列元素.D的原子序数比E小6,D跟B可形成离子化合物其晶胞结构如图.请回答:
(1)A与B形成的化合物在固态时的晶体类型是______;A与B形成的化合物比A与C形成的化合物熔点要______(填高、低)
(2)写出C的单质与水反应的离子方程式______;
(3)如图所示,D跟B形成的离子化合物的化学式为______;鉴别该离子化合物是否为晶体,最可靠的科学方法是______,该离子化合物晶体的密度为ag?cm-3,B、D两元素的相对原子质量分别为b、c,则晶胞的体积是______cm3(只要求列出算式).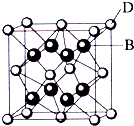
参考答案:已知A、B、C、D、E都是元素周期表中前36号的元素,其原子序数依次增大,E是周期表中1-18列中的第8列元素,所以E是Fe元素;D的原子序数比E小6,所以D是Ca元素;D跟B可形成离子化合物,该晶胞中含有B离子8个,D离子个数8×18+6×12=4,所以该化学式为D2B,B为第VIIA族元素,B和C属同一主族,且B的原子序数小于C,所以B是F元素,C是Cl元素,A与其他4种元素既不在同一周期又不在同一族,所以A是H元素.
(1)HF是共价化合物,形成的晶体是分子晶体,分子晶体的中物质的沸点随着相对分子质量的增大而增大,但分子间形成氢键的化合物使物质的沸点升高,氟化氢中含有氢键,氯化氢中不含氢键,所以氟化氢的沸点高于氯化氢,故答案为:分子晶体;高;
(2)氯气和水反应生成强电解质氯化氢和弱电解质次氯酸,所以其离子方程式为:Cl2+H2O=H++Cl-+HClO,故答案为:Cl2+H2O=H++Cl-+HClO;
(3)Ca元素跟F元素可形成离子化合物,该晶胞中含有B两离子8个,D离子个数8×18+6×12=4,所以该化学式为CaF2,鉴别该离子化合物是否为晶体,最可靠的科学方法是X射线衍射法;
每个氟化钙晶胞中含有4个钙离子、8个氟离子,所以每个晶胞的质量为4MNA,密度是ag?cm-3,所以晶胞的体积=4(c+2b)NAacm3=8b+4caNAcm3,
故答案为:CaF2;X射线衍射法;8b+4caNA.
本题解析:
本题难度:一般
5、填空题 卤族元素包括氟(F)、氯(Cl)、溴(Br)、碘(I),请预测下列物质的性质:
(1)熔点: F2?Cl2(填“<”或“=”“或>”,下同),沸点:HF?HCl,一定压强下HF和HCl的混合气体降温时?(填HF或HCl)先液化。
(2)分解温度:HF?HCl,熔点:NaF?SiF4
参考答案:

本题解析:略
本题难度:简单
|