1、实验题 下图A是实验室用石灰石和稀盐酸制取CO2的常用装置。请选用适当的化学试剂和实验用品,用图中的D装置收集一瓶干燥、纯净的CO2气体。
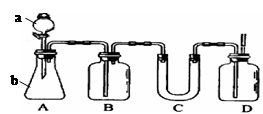
(1)a和b的仪器名称分别是?、?。
(2)检验D中气体是否收集满了的操作是:_________________________________。
(3)B中装入一定量的饱和NaHCO3目的除去A挥发的HCl反应的方程式?
(4)C中装入干燥剂除去水蒸气,可选择干燥剂是?
a浓硫酸? b烧碱? c无水氯化钙? d碱石灰
参考答案:(1)?分液漏斗?、?锥形瓶?(2)燃着木条靠近集气瓶
(3) NaHCO3+HCl=NaCl+H2O+CO2?(4)? C
本题解析:CO2气体不能燃烧,故用燃着的木条靠近集气瓶,若木条熄灭,则表明集满气体。饱和NaHCO3与CO2不反应,故能用于除杂。C装置为U型管,用于装固体干燥剂。CO2是酸性气体,故不能用烧碱和碱石灰干燥。
点评:对化学实验的考查是历年的高考重点,考生在备考中应注意对化学仪器的使用、化学实验现象、实验安全、常见物质的制备及收集等的相关知识的积累。知识点较多,难度较大。
本题难度:一般
2、填空题 为了证明CO具有还原性,有人利用下列装置设计了系列的实验,其中A为气体发生装置,C为尾气处理装置,X装置可以盛放不同的试剂重复使用。已知草酸与浓硫酸共热发生如下反应:
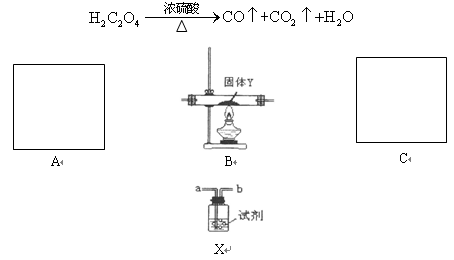
(1)若以草酸.浓硫酸为原料制备一氧化碳,则该气体发生装置中所用到的玻璃仪器除了导管外,还有______________________________。
(2)装置连接无误,装入药品后,在加热装置B之前应进行的一步操作是__________,C中尾气的的处理方法是______________________________。
(3)已知B中固体为CuO,现要制得纯净干燥的CO以验证其还原性,则A.B之间放置的X装置(可重复)中所装试剂依次为:____________________, 澄清石灰水,____________________,证明CO具有还原性的现象为____________________。
(4)除上述现象外,若再用一次X装置,还有一种能说明CO具有还原性的现象,
则装置X的安装位置及所装试剂为:______________________________,现象为:________________________________________。
参考答案:(1)圆底烧瓶.分液漏斗.酒精灯
(2)先让A反应一段时间,收集C中的气体并检验其纯度;点燃法或气囊收集法等
(3)NaOH溶液(2分);浓硫酸(2分);B中黑色固体变红
(4)将X接于B.C之间,所装试剂为澄清石灰水(2分);
A.B间澄清石灰水不变浑浊,B.C间澄清石灰水变浑浊(2分)
本题解析:(1)根据反应原理可知,该反应是液体和液体之间通过加热制备气体的,所以还需要的仪器有圆底烧瓶、分液漏斗、酒精灯,
(2)由于生成的CO是可燃性气体,所以在加热装置B之前应进行的一步操作是先让A反应一段时间,收集C中的气体并检验其纯度。CO有毒,具有可燃性,所以通过点燃法或气囊收集法等进行尾气处理。
(3)由于生成的CO中含有CO2和水蒸气,所以需要首先除杂。为了保证CO2完全除去,则为还需要利用澄清的石灰水来检验CO2是否除尽。除去CO2用氢氧化钠溶液,干燥CO应该用浓硫酸。CO具有还原性,能把氧化铜还原生成单质铜,所以证明CO具有还原性的现象为B中黑色固体变红。
(4)由于CO的氧化产物是CO2,所以还可以通过检验CO2的生成来说明。即将X接于B.C之间,所装试剂为澄清石灰水,而实验现象是A.B间澄清石灰水不变浑浊,B.C间澄清石灰水变浑浊。
点评:该题是中等难度的试题,试题综合性强,难易适中,有利于培养学生的逻辑推理能力和规范严谨的实验设计能力。该类试题主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确及灵活运用知识解决实际问题的能力。
本题难度:一般
3、填空题 (10分)二氧化锰是制造锌锰干电池的基本原料,普通锌锰干电池的电池反应式为:2MnO2+Zn+2H2O=2MnOOH+Zn(OH)2。工业上以软锰矿为原料,利用硫酸亚铁制备高纯度二氧化锰的流程如下(软锰矿中所有金属元素在酸性条件下均以阳离子形式存在):
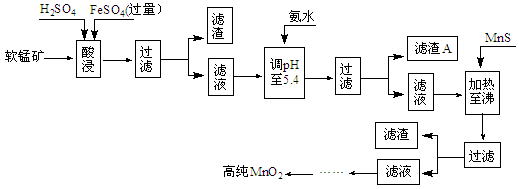
某软锰矿的主要成分为MnO2,还含Si(16.27%)、Fe(5.86%)、Al(3.24%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。部分阳离子以氢氧化物形式完全沉淀时,溶液的pH及部分硫化物的Ksp(均为25℃时)见下表,回答下列问题:
沉淀物
| Al(OH)3
| Fe(OH)3
| Fe(OH)2
| Mn(OH)2
| Cu(OH)2
| Zn(OH)2
|
pH
| 5.2
| 3.2
| 9.7
| 10.4
| 6.7
| 8.0
|
沉淀物
| CuS
| ZnS
| MnS
| FeS
| ?
| ?
|
Ksp
| 8.5×10-45
| 1.2×10-23
| 1.4×10-15
| 3.7×10-14
| ?
| ?
|
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要离子方程式为:
?。
(2)滤渣A的主要成分为?。
(3)加入MnS的目的是除去?杂质。
(4)碱性锌锰电池中,MnO2参与的电极反应式为??。
(5)从废旧碱性锌锰电池中可回收利用的物质有?(写两种)。
参考答案:(1)MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O
(2)Fe(OH)3、Al(OH)3。(3)Cu2+、Zn2+。
(4)MnO2+H2O+e-=MnOOH+OH-。(5)锌、二氧化锰。
本题解析:酸液中发生二氧化锰的氧化性氧化亚铁离子,PH<5.4滤渣A的主要成分为铁的沉淀和铝的沉淀。加入MnS的目的是除去铜离子和锌离子。KSP小生成,CuS、 ZnS沉淀。碱性锌锰电池中,锰做正极被还原MnO2+H2O+e-=MnOOH+OH-。从废旧碱性锌锰电池中可回收利用的物质有锌和二氧化锰。
本题难度:一般
4、实验题 塑化剂DBP(邻苯二甲酸二丁酯)主要应用于PVC等合成材料中作软化剂。反应原理为:
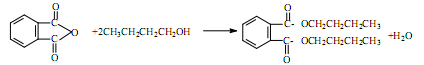
实验步骤如下:
步骤1:在三颈瓶中放入14.8g邻苯二甲酸酐、25mL正丁醇、4滴浓硫酸,开动搅拌器b(反应装置如图)。
步骤2:缓缓加热至邻苯二甲酸酐固体消失,升温至沸腾。
步骤3:等酯化到一定程度时,升温至150℃
步骤4:冷却,将三颈瓶中的液体倒入分漏斗中,用饱和食盐水和5%碳酸钠洗涤。
步骤5:减压蒸馏,收集200~210℃2666Pa馏分,即得DBP产品
(1)浓硫酸的作用?,搅拌器的作用?。
(2)反应过程中正丁醇过量的目的是?。
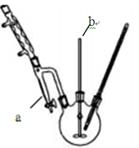
(3)图中仪器a的名称是分水器,试分析它的作用是?。
步骤3中确定有大量酯生成的依据是?。
(4)碳酸钠溶液洗涤的目的是?。
用减压蒸馏的目的是?。
(5)写出正丁醇在135℃生成醚的反应方程式?。
写出DBP在氢氧化钠溶液中水解的方程式?。
参考答案:(共12分)
(1)催化剂、脱水剂,2分,各1分?使反应物充分混合1分
(2)增大正丁醇的含量,可促使反应正向移动,增大邻苯二甲酸酐的转化率1分
(3)及时分离出酯化反应生成的水,促使反应正向移动;1分
分水其中有大量的水生成1分
(4)用碳酸钠除去酯中的醇和酸;1分
减压蒸馏可降低有机物的沸点,可以防止有机物脱水碳化,提高产物的纯度。1分
(5)2CH3(CH2)2CH2OH?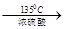 ?= CH3(CH2)3O(CH2)3CH3+H2O
?= CH3(CH2)3O(CH2)3CH3+H2O
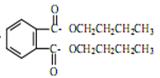 +2NaOH
+2NaOH  2CH3(CH2)2CH2OH+2H2O+
2CH3(CH2)2CH2OH+2H2O+
方程式各2分,条件不写或错误扣1分
本题解析:(1)根据题中信息得,浓硫酸的作用为催化剂、脱水剂。搅拌器的作用为使反应物充分混合。
(2)反应过程中正丁醇过量的目的是增大正丁醇的含量,可促使反应正向移动,增大邻苯二甲酸酐的转化率。
(3)分水器的作用是时分离出酯化反应生成的水,促使反应正向移动。确定有大量酯生成的依据是分水其中有大量的水生成。
(4)碳酸钠溶液洗涤的目的是用碳酸钠除去酯中的醇和酸。用减压蒸馏的目的是减压蒸馏可降低有机物的沸点,可以防止有机物脱水碳化,提高产物的纯度。
(5)根据题中信息得,正丁醇在135℃生成醚的反应方程式为2CH3(CH2)2CH2OH?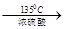 ?= CH3(CH2)3O(CH2)3CH3+H2O。DBP在氢氧化钠溶液中水解的方程式为
?= CH3(CH2)3O(CH2)3CH3+H2O。DBP在氢氧化钠溶液中水解的方程式为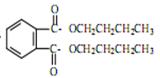 +2NaOH
+2NaOH  2CH3(CH2)2CH2OH+2H2O+
2CH3(CH2)2CH2OH+2H2O+ 。
。
点评:本题考查的是塑化剂的应用和有机反应的相关知识,题目难度大,利用好题中的信息是解题的关键。
本题难度:一般
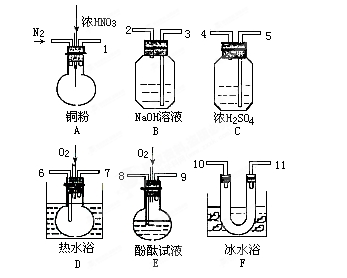
5、实验题 用下列仪器、药品验证由铜和适量硝酸反应产生的气体中含NO(仪器可选择使用,N2和O2的用量可自由控制)。已知:
① 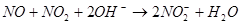
② 气体液化温度:NO2 21℃, NO -152℃
试回答:
(1)仪器的连接顺序(按左→右连接,填各接口的编号)为____。
(2)反应前先通入N2,目的是______。
(3)确认气体中含NO的现象是________。
(4)装置F的作用是________。
(5)如果O2过量,则装置B中发生反应的化学方程式为_____。
参考答案:(1)①⑤④(10)(11)(或(11)(10))⑥⑦③。
(2)驱赶装置中的空气,防止产生的NO被氧化;
(3)通入O2后装置D中有红棕色气体生成;
(4)使NO2液化(分离NO2和NO);
(5)4NO2+O2+4NaOH=4NaNO3+2H2O
本题解析:
【错解分析】框图分析
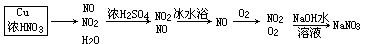
【正解】本实验的目的是验证Cu和浓HNO3反应产生的气体中的NO,即产物中一定有NO,而不是通过实验来确定是否有NO。而反应产物中NO2是一定存在的,所以要将NO2和NO分离后进行验证,如何分离?题目给出了两种气体相差甚远的液化温度,联系装置F,便知其意了。NO2和NO分离(NO2被液化)后的气体与O2作用,又出现红棕色,这个特征现象便确认了NO的存在。另外,制气前须将各装置内的空气排尽(否则会氧化NO),气体中混有的水气的吸收以及最后尾气的吸收,这些问题都要考虑。而盛酚酞的装置E便成了命题者用来干扰思维的多余装置。
本题难度:一般