1、填空题 一定温度下,在容积为V L的密闭容器中进行反应:aN(g) bM(g),M、N的物质的量随时间的变化曲线如图所示:
bM(g),M、N的物质的量随时间的变化曲线如图所示:
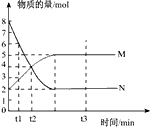
(1) 此反应的化学方程式中a :b=__________
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为:_________________________
(3)下列叙述中能说明上述反应达到平衡状态的是_______________
A.反应中M与N的物质的量之比为1︰1
B.混合气体的总质量不随时间的变化而变化
C.混合气体的总物质的量不随时间的变化而变化
D.单位时间内每消耗a mol N,同时生成b mol M
E.混合气体的压强不随时间的变化而变化
F.N的质量分数在混合气体中保持不变
参考答案:(1)a :b=2:1
(2) 1/(t2-t1)V mol·L-1· min-1
(3) CEF
本题解析:
本题难度:一般
2、填空题 气候变暖冰川融化将会对人类产生极大的灾害。如南极冰盖全部融化,南太平洋上的美丽岛国图瓦卢很可能成为首个“沉没”的国家,喜马拉雅山冰川融化尼泊尔会有“灭顶”之灾,近海城市遭受城市淹没、海啸等灾害。所以合理利用资源,加强环境保护。降低碳的排放,实施低碳经济是今后经济生活主流。
(1)下列措施对有效减少二氧化碳排放和降低大气中二氧化碳不适合的是___________________
A.使用天然气等燃料
B.植树造林,保护森林,保护植被
C.大力发展风能、水力、潮汐能发电和核电,大力推行太阳能的综合开发
D.立即减少煤和石油化石燃料的使用
E.建筑物中尽量利用自然通风采光,推广使用节能灯和节能电器,使用空调时夏季温度不宜设置过低,冬天不宜过高
F.全民倡导出行时多步行和骑自行车;建设现代物流信息系统,减少运输工具空驶率
(2)目前用超临界CO2(其状态介于气态和液态之间)代替氟利昂作致冷剂已成为一种趋势,这一做法对环境的积极意义在于保护______________________。
(3)科学家致力于二氧化碳的“组合转化”技术研究,把过多的二氧化碳转化为有益于人类的物质。如将CO2和H2以1∶4比例混合通入反应器,在适当条件下反应可获得一种重要能源。请完成以下化学方程式:CO2+4H2==___________+2H2O
(4)收集提纯炼铁、炼钢等工厂所排放的气体,可得高纯度的CO,在适当的条件下,用CO和H2反应可获得人工合成汽油,也可减少碳的排放,节约能源。假设此人工合成汽油是碳原子数为5~8的烷烃,要达到合成汽油的要求,通入反应装置里的CO和H2的物质的量之比范围是______≤n(CO)/n(H2) ≤______(保留最简分数比形式)
(5)探究CO2来生产燃料甲醇(CH3OH)的反应原理,现进行如下实验在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)测得CO2和CH3OH(g)的浓度随时间变化如下图所示。
CH3OH(g)+H2O(g)测得CO2和CH3OH(g)的浓度随时间变化如下图所示。
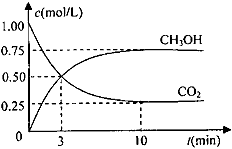
从反应开始到平衡,氢气的平均反应速率v(H2)=_________________。
参考答案:(1)AD
(2)臭氧层
(3)CH4
(4)5/11;8/17
(5)0.225 mol/(L·min)
本题解析:
本题难度:一般
3、选择题 对于在恒温的密闭容器中进行的反应:N2(g)+O2(g)=2NO(g),下列情况下该反应的化学反应速率保持不变的是?
A.缩小容器体积,使压强增大
B.保持体积不变,充入O2
C.保持体积不变,充入氦气
D.保持压强不变,充入氦气
参考答案:C
本题解析:考查外界条件对反应速率的影响。A属于增大压强,反应速率加快。B属于增大氧气浓度,反应速率加快。C中反应体系中物质的浓度不变,所以反应速率不变。D中要保持压强不变,则容器容积必须增大,从而导致物质的浓度减小,由此反应速率降低。答案选C。
本题难度:一般
4、填空题 氢能被视为未来的理想清洁能源,科学家预测“氢能”将是21世纪最理想的新能源。目前分解水制氢气的工业制法之一是“硫—碘循环”,主要涉及下列反应:
Ⅰ? SO2+2H2O+I2= H2SO4+2HI Ⅱ? 2HI H2+I2
H2+I2
Ⅲ? 2H2SO4= 2SO2↑+O2↑+2H2O
(1)分析上述反应,下列判断正确的是?。
a.反应Ⅲ易在常温下进行? b.反应I中SO2还原性比HI强
c.循环过程中需补充H2O? d.循环过程中产生1molO2的同时产生1molH2
(2)一定温度下,向2L密闭容器中加入1mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示。0—2min内的平均反应速率v(HI)=? ?。该温度下,反应2HI(g) H2(g)+I2(g)的平衡常数K=?。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则?是原来的2倍。
H2(g)+I2(g)的平衡常数K=?。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则?是原来的2倍。

a.平衡常数? b.HI的平衡浓度?
c.达到平衡的时间? d.平衡时H2的体积分数
(3)SO2在一定条件下可被氧化生成SO3,其反应为:2SO2 (g) + O2(g)  2SO3(g)?△H<0。某科研单位利用原电池原理,用SO2和O2来制备硫酸,装置如图,电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触。
2SO3(g)?△H<0。某科研单位利用原电池原理,用SO2和O2来制备硫酸,装置如图,电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触。

①a电极的电极反应式为?;
②若得到的硫酸浓度仍为49%,则理论上参加反应的SO2与加入的H2O的质量比为?。?
(4)实际生产还可以用氨水吸收SO2生成亚硫酸的铵盐。现取a克该铵盐,若将其中的SO2全部反应出来,应加入10 mol/L的硫酸溶液的体积范围为?。
参考答案:(1)bc(2分)
(2)0.05mol·L-1·min-1(2分);1.56×10-2或1/64(2分);b (2分)
(3)①SO2 +2H2O-2e-=SO42-+ 4H+(2分)?②8∶15(2分)
(4) (a/1160)L~(a/1980)L (3分)
本题解析:(1)反应Ⅲ,2H2SO4==2SO2↑+O2↑+2H2O,硫酸是高沸点,在常温下不易分解,a不正确;反应I,SO2+2H2O+I2= H2SO4+2HI中,反应物SO2还原性比产物HI强,b正确;循环过程中H2O被分解为H2和O2,故需补充H2O不正确;由H2O被分解可知产生1molO2的同时产生2molH2,D不正确。
(2)v(HI)= 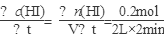 =0.05mol·L-1·min-1。该温度下,反应2HI(g)
=0.05mol·L-1·min-1。该温度下,反应2HI(g) H2(g)+I2(g)到达平衡时,c(H2)=c(I2)= 0.1mol·L-1,c(HI)= 0.8mol·L-1的平衡常数K=
H2(g)+I2(g)到达平衡时,c(H2)=c(I2)= 0.1mol·L-1,c(HI)= 0.8mol·L-1的平衡常数K=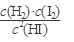 =1.56×10-2。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,温度不变平衡常数不变;加压平衡不移动,故HI的平衡浓度是原来的2倍;浓度最大,速率加快,达到平衡的时间少于原来的2倍;平衡时H2的体积分数不变。
=1.56×10-2。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,温度不变平衡常数不变;加压平衡不移动,故HI的平衡浓度是原来的2倍;浓度最大,速率加快,达到平衡的时间少于原来的2倍;平衡时H2的体积分数不变。
(3)①a电极得到电子,物质被氧化,故是SO2通入的电极,反应式为SO2 +2H2O-2e-=SO42-+ 4H+;
②理论上2SO2+2H2O+O2==2H2SO4,硫酸浓度仍为49%假设49g即0.5mol H2SO4,需要SO2是0.5mol、H2O是0.5mol,硫酸溶液中还有水51g,理论上参加反应的SO2与加入的H2O的质量比为0.5mol×32g·mol-1:(0.5mol×18g·mol-1+51g)=8:15。
(4)实际生产还可以用氨水吸收SO2生成亚硫酸的铵盐。即(NH4)2SO3或NH4HSO3现取a克该铵盐,让它们分别于硫酸溶液反应,可计算出体积范围为(a/1160)L~(a/1980)L。
本题难度:一般
5、填空题 830K时,在密闭容器中发生下列可逆反应:
CO(g)+H2O(g) ?CO2(g)+H2(g);△H<0?试回答下列问题:
?CO2(g)+H2(g);△H<0?试回答下列问题:
(1)若起始时c(CO)="2" mol?L-1,c(H2O)="3" mol?L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K=?.
(2)在相同温度下,若起始时c(CO)="1" mol?L-1,c(H2O)="2" mol?L-1,反应进行一段时间后,测得H2的浓度为0.5 mol?L-1,则此时该反应是否达到平衡状态 ?(填“是”与“否”),?此时v(正)??v(逆)(填“大于”“小于”或“等于”),你判断的依据是?
?。
(3)若降低温度,该反应的K值将?(均填“增大”“减小”或“不变”)。
参考答案:(1)平衡常数k=1
(2)否?大于?依据是Q=0.5×0.5/0.5×1.5<1即Q<K,所以未达平衡,V(正)>V(逆)
(3)增大
本题解析:(1)? CO(g)+H2O(g) ?CO2(g)+H2(g)
?CO2(g)+H2(g)
起始浓度(mol/L)? 2? 3? 0? 0
之和浓度(mol/L)? 1.2? 1.2? 1.2? 1.2
平衡浓度(mol/L)? 0.8? 1.8? 1.2? 1.2
所以平衡常数K=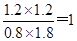
(2)在相同温度下,若起始时c(CO)="1" mol?L-1,c(H2O)="2" mol?L-1,反应进行一段时间后,测得H2的浓度为0.5 mol?L-1,则根据方程式可知,此时CO2的浓度也是0.5mol/L,而CO和水蒸气的浓度分别是0.5mol/L和1.5mol/L,则此时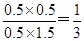 <1,所以反应没有达到平衡状态。此时正反应速率大于逆反应速率。
<1,所以反应没有达到平衡状态。此时正反应速率大于逆反应速率。
(3)正反应是放热反应,则降低温度,平衡向正反应方向进行,所以该反应的K值将增大。
点评:该题是高考中的常见题型和重要的考点,属于中等难度的试题。试题贴近高考,基础性强,侧重对学生灵活运用基础知识解决实际问题的能力的培养。该题的关键是明确平衡常数的含义、计算依据以及影响因素,如何结合题意灵活运用即可。有利于调动学生的学习兴趣,提高学生的应试能力。
本题难度:一般