|
高考化学试题《反应速率与平衡的有关计算》高频考点强化练习(2020年最新版)(八)
2021-02-18 07:08:56
【 大 中 小】
|
1、填空题 合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响。合成氨反应的化学方程式为N2(g)+3H2(g) 2NH3(g) ΔH=-92.2 kJ·mol-1。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷或焦炭与水蒸气反应制得。 2NH3(g) ΔH=-92.2 kJ·mol-1。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷或焦炭与水蒸气反应制得。
(1)在一容积固定的密闭容器中注入N2和H2两种气体,发生上述反应,在某温度下达到平衡时,各物质的浓度分别是:c(H2)=9.00 mol·L-1,c(N2)=3.00 mol·L-1,c(NH3)=4.00 mol·L-1,此温度下该反应的平衡常数K=________。
(2)在三个相同容器中各充入1 mol N2和3 mol H2,在不同条件下反应并达到平衡,氨的体积分数随时间变化的曲线如图所示。下列说法中正确的是________(填字母)。
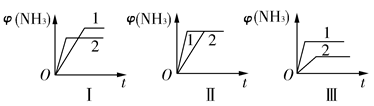
A.图Ⅰ可能是不同压强对反应的影响,且p2>p1
B.图Ⅱ可能是不同压强对反应的影响,且p1>p2
C.图Ⅲ可能是不同温度对反应的影响,且T1>T2
D.图Ⅱ可能是同温同压下不同催化剂对反应的影响,且催化剂性能1>2
| (3)将水蒸气通过红热的炭即可产生水煤气,化学方程式为:C(s)+H2O(g)=H2(g)+CO(g)
ΔH=+131.3 kJ·mol-1,ΔS=+133.7J·K-1 ·mol-1
该反应在常温下能否自发进行?________(填“能”或“不能”)。
参考答案:(1)7.32×10-3 (2)D (3)不能
本题解析:(1)K=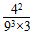 =7.32×10-3 =7.32×10-3
(2)压强越大,φ(NH3)应该大,A错误。
改变压强,φ(NH3)改变,B错误。
温度越高,φ(NH3)越小,C错误。
催化剂增大速率,缩短达到平衡的时间,平衡不移动,D正确。
(3)ΔH-TΔS=131.3 kJ·mol-1-298 K×0.1337 kJ·K-1· mol-1=91.45 kJ·mol-1>0,所以不能自发进行。
本题难度:一般
2、选择题 在已达平衡的可逆反应2SO2+O2 2SO3体系中,加入一定量的18O2,足够长时间后,在_______________物质中存在18O原子。 2SO3体系中,加入一定量的18O2,足够长时间后,在_______________物质中存在18O原子。
参考答案:SO2、SO3、O2
本题解析:18O2可生成含18O的SO3,同时含18O的SO3也会分解产生SO2,此时,SO2中也可能含有18O。
本题难度:简单
3、选择题 用来表示可逆反应:2A(g)+B(g)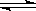 3C(g)(正反应放热)的正确图象是下图中的?(?) 3C(g)(正反应放热)的正确图象是下图中的?(?)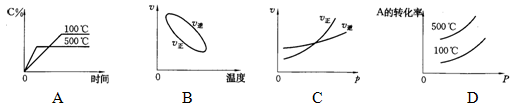
参考答案:A
本题解析:A、温度越高,速率越快,图像陡,升高温度平衡逆向移动,C%减小;
B、温度升高,正逆反应速率均增加;
C、因为是体积不变的反应,增大压强,平衡不移动。
D、压强增大,平衡不移动,A的转化率不变。温度升高,平衡逆向移动,A转化率减小。
本题难度:一般
4、选择题 在恒温、体积为2L的密闭容器中进行反应:2A(g)?3B(g)+C(g),若反应物在前20sA物质由3mol降为1.8mol,则前20s的平均反应速度为( )
A.v(B)=0.03mol/(L?s)
B.v(B)=0.045mol/(L?s)
C.v(C)=0.03mol/(L?s)
D.v(C)=0.06mol/(L?s)
参考答案:反应物在前20sA物质由3mol降为1.8mol,则A的反应速率为(3mol-1.8mol)2L20s=0.03mol/(L?s),
由反应速率之比等于化学计量数之比可知,
v(B)=0.03mol/(L?s)×32=0.045mol/(L?s),
v(C)=0.03mol/(L?s)×12=0.015mol/(L?s),
故选:B.
本题解析:
本题难度:简单
5、填空题 碘钨灯具有使用寿命长、节能环保等优点。一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生如下的可逆反应:W(s)+I2(g)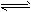 WI2(g)。为模拟上述反应,在实验室中准确称取 WI2(g)。为模拟上述反应,在实验室中准确称取
0.508 g碘、0.736 g金属钨放置于50.0 mL密闭容器中,并加热使其反应。下图是混合气体中的WI2蒸气的物质的量随时间变化关系的图象[n(WI2)-t],其中曲线I(0 ~t2:时间段)的反应温度为450℃,曲线Ⅱ(从t2时刻开始)的反应温度为530℃。

请回答下列问题:
(1)该反应是_____(填“放热”或“吸热”)反应。
(2)反应从开始到t1(t1 =3min)时间内的平均速率v(I2)=____________
(3)在450℃时,该反应的平衡常数K=________。
(4)能够说明上述反应已经达到平衡状态的有____________。
A.I2与WI2的浓度相等
B.单位时间内,金属钨消耗的物质的量与单质碘生成的物质的量相等
C.容器内混合气体的密度不再增加
D.容器内气体压强不变化
(5)假设灯丝温度为660℃,灯泡壁温度为350℃。请根据化学反应原理分析在灯泡内充入碘能够延长钨丝寿命的原因____________________________。
参考答案:(1)放热
(2) 1.20×10-2mol·L-1·min-1
(3)9
(4)BC
(5)扩散到灯泡内壁(低温区)的钨与I2(g)发生反应生成WI2(g),WI2(g)扩散到灯丝(高温区)重新分解出钨沉积到灯丝表面,从而延长钨丝使用寿命。
本题解析:
本题难度:一般
|