|
高考化学试题《常见的化学电源》典型例题(十)
2021-02-18 07:09:37
【 大 中 小】
|
1、选择题 胶体燃料电池是电动车常用的四种蓄电池中的一种,该电池的总反应式为:
2PbSO4 + 2H2O ?Pb + PbO2 + 2H2SO4。下列说法正确的是 ?Pb + PbO2 + 2H2SO4。下列说法正确的是
A.胶体能发生电泳是由于胶体带电
B.放电时,Pb为负极,电极反应式为Pb- 2e? = Pb2+
C.这种电池达到使用寿命之后可以随意丢弃,不会造成环境污染
D.利用这种电池电解精炼铜,当阴极析出0.64g铜时,该蓄电池中消耗H2SO4 0.02mol
参考答案:D
本题解析:略
本题难度:一般
2、选择题 下面是两种常见的化学电源示意图,有关说法不正确的是( )
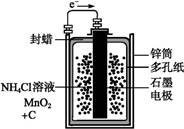
干电池示意图

铅蓄电池示意图
A.上述电池分别属于一次电池、二次电池
B.干电池在长时间使用后,锌筒被破坏
C.铅蓄电池工作过程中,每通过2 mol电子,负极质量减轻207 g
D.铅蓄电池负极材料为Pb
|
参考答案:C
本题解析:选项A正确。在干电池中,Zn作负极,被氧化,B正确。C项忽略了硫酸铅在该极上析出,该极质量应该增加而非减少。
考点:燃料电池
本题难度:一般
3、填空题 铅蓄电池是常用的化学电源,其电极材料分别是Pb和PbO2,电解液为硫酸。工作时该电池总反应式为
Pb+PbO2+2H2SO4==2PbSO4+2H2O。根据上述情况判断:
(1)蓄电池的负极材料是____。工作时,正极反应为____。
(2)工作时,电解质溶液的pH___(填“增大”、“减小”或“不变”)。
(3)工作时,电解质溶液中的阴离子移向____极。电流方向从____极流向____极。
参考答案:(1)Pb; PbO2+2e-+4H++SO42- == PbSO4+2H2O
(2)增大
(3)负; 正; 负
本题解析:
本题难度:一般
4、简答题 Ⅰ.已知甲醇燃料电池的工作原理如图1所示.
①该电池工作时,b口通入的物质为______,c口通入的物质为______.
②该电池负极的电极反应式为______.
Ⅱ.如图2所示:甲、乙为相互串联的两电解池.试答:
(1)乙池中C极电极反应式为______,若在乙池中滴入少量酚酞试液,开始电解一段时间,铁极附近呈______色.
(2)甲池若为用电解原理精炼铜的装置,则A电极名称为______极,电极反应式为______,溶液可以是______.
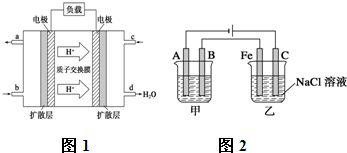
参考答案:Ⅰ.①根据装置可以知道d处生成大量的水,氢离子移向的电极为原电池的正极,所以c电极是通入的氧气,b口通入的物质为甲醇,故答案为:CH3OH; O2;
②d处生成大量的水,所以c电极是通入的氧气,为正极,b口通入的物质为甲醇,为负极,正极发生电极反应为:O2+4e-+4H+=2H2O,依据电池总反应为:2CH3OH+3O2=2CO2+4H2O;总化学方程式-正极×3得到负极电极反应为:CH3OH+H2O-6e-═CO2+6H+;故答案为:CH3OH+H2O-6e-═CO2+6H+;
Ⅱ.(1)依据装置图中的电源正负极判断,A为阴极,B为阳极,Fe为阴极,C为阳极;乙池中阳极为惰性电极,溶液中的Cl-放电能力大于OH-,电极反应为:2Cl--2e-═Cl2↑,阴极上是溶液中的阳离子得到电子发生还原反应,溶液中的氢离子得到电子生成氢气,电极反应为:2H++2e-=H2↑,阴极Fe附近水的电离平衡被破坏,氢氧根离子浓度增大,遇酚酞变红;故答案为:红;
(2)甲池若为用电解原理精炼铜的装置,粗铜做阳极,精铜做阴极,含铜离子的电解质溶液;A电极名称为阴极;电解质溶液为 CuSO4溶液或CuCl2溶液;溶液中铜离子得到电子生成铜,电极反应为:Cu2++2e-═Cu;
故答案为:阴;? Cu2++2e-═Cu;?CuSO4溶液或CuCl2溶液;
本题解析:
本题难度:一般
5、填空题 甲醇是一种优质燃料,可制作燃料电池。
(1)工业上可用下列两种反应制备甲醇:
CO(g) + 2H2(g)  CH3OH(g) ΔH1 CH3OH(g) ΔH1
CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH2 CH3OH(g) + H2O(g) ΔH2
已知:2H2(g)+ O2(g) = 2H2O(g) ΔH3。则2CO(g)+O2(g) = 2CO2(g) 的反应热
ΔH=_____________(用ΔH1、ΔH2、ΔH3表示)。
(2)生产甲醇的原料CO和H2来源于:CH4(g) + H2O(g)  CO(g) + 3H2(g) ΔH4。 CO(g) + 3H2(g) ΔH4。
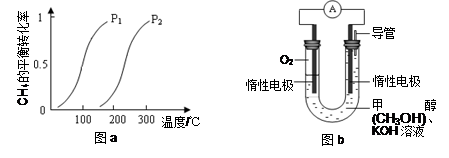
一定条件下CH4的平衡转化率与温度、压强的关系如图a。则ΔH4______0,P1_________P2
(填“<”、“>”或“=”)
(3)某实验小组设计如图b所示的甲醇燃料电池装置,工作一段时间后,溶液的PH (填增大、减小、不变)。负极的电极反应式为_______ ______。
(4)黄铜矿熔炼后得到的粗铜含少量Fe、Ag、Au等金属杂质,需进一步采用电解法精制。粗铜电解得到精铜的的电解池中,阳极材料是 ;阴极材料是 ;
阳极泥为: &# 91eXAm.org160;
参考答案:(1)2ΔH1-2ΔH2+ΔH3 (2分) (2) > (2分) <(2分)
(3) 减小 (2分) CH3OH-6e-+8OH-=CO32-+6H2O (3分)
(4)粗铜, 精铜, Ag、Au (3分)
本题解析:(1)根据盖斯定律可知,①×2+③-②×2即达到反应2CO(g)+O2(g)=2CO2(g) ,所以该反应的反应热ΔH=2ΔH1-2ΔH2+ΔH3。
(2)根据图像可知在压强相同的条件下,升高温度甲烷的转化率增大,这说明温度升高平衡向正反应方向移动,所以正方应是吸热反应,即△H大于0;正方应是体积增大的可逆反应,则增大压强平衡向逆反应方向移动,甲烷的转化率降低。所以根据图像可知,在温度相同的条件下,P1对应的转化率高,则P1小于P2。
(3)甲醇在反应中失去电子,所以甲醇在负极通入,电极反应式是CH3OH-6e-+8OH-=CO32-+6H2O,即反应后有碳酸钾生成,消耗氢氧化钾,所以溶液的pH减小。
(4)粗铜精练时,粗铜和电源的正极相连,做阳极,纯铜和电源的负极相连,做阴极。粗铜中的Ag、Au等杂质不失去电子,成为阳极泥。
考点:考查反应热的计算、外界条件对平衡状态的影响、电极反应式的判断和书写阳极粗铜的冶炼
点评:该题是高考中的常见题型,属于中等难度的试题。试题贴近高考,综合性强,在注重对学生基础知识巩固与训练的同时,侧重对学生能力的培养与解题方法的指导和训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和发散思维能力。
本题难度:一般
|