1、实验题 为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如下图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球。
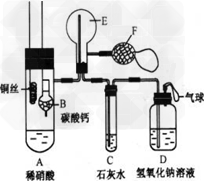
(1)实验时,为在E烧瓶中收集到NO,以便观察颜色,必须事先赶出去其中的空气。其中第一步实验操作为_______________。如何确定E中空气已被赶尽____________。
(2)将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的离子方程式为_________________。
(3)如何证明E中收集到的是NO而不是H2?________________?。一段时间后,C中白色沉淀溶解,其原因是_______________。
(4)装置D的作用是_____________________。
2、填空题 如何检验实验室用KClO3和MnO2制取氧气后的产物中有Cl-存在:______.
3、简答题 无水亚硫酸钠隔绝空气加热到600℃便开始分解,分解产物是硫化钠和另外一种固体.某学生将无水亚硫酸钠受热后的试样溶于水制成浓溶液,用下图所示的实验装置进行实验,他向试样溶液中缓缓地逐滴加入稀盐酸,根据实验现象判断固体试样含有什么成分?(已知:Na2?S+2HCl═2NaCl+H2S+SO2+2H2S═3S+2H2?O)
(1)无水亚硫酸钠受热分解的化学方程式是______,装置中的NaOH溶液的作用是______.
(2)如果加热温度在600℃以上,再向所得固体的试样溶液中缓缓滴加稀盐酸至足量,观察到CuSO4溶液中出现黑色沉淀,试分析其他装置中可能出现的现象.试样溶液:______,解释这种现象的离子方程式是______;品红溶液:______,出现这种现象的原因是:______.
(3)若加入了足量的稀盐酸后,品红溶液和CuSO4溶液中仍无明显的现象发生,原因是______.
4、选择题 下列有关物质性质实验的叙述,正确的是
A.钠在空气中燃烧,生成淡黄色的氧化钠粉末
B.镁在二氧化碳中燃烧,生成白色的氧化镁和黑色的炭
C.将灼热的铁丝放人盛有氯气的集气瓶中,生成棕黄色的氯化铁烟雾
D.在铜和浓硫酸加热反应后的混合液中加水,得到无色硫酸铜溶液
5、实验题 (18分)实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4++6HCHO=3H++6H2O+(CH2)6N4H+[滴定时,1 mol (CH2)6N4H+与 l mol H+相当],然后用NaOH标准溶液滴定反应生成的酸,某兴趣小组用甲醛法进行了如下实验:
步骤Ⅰ称取1.500 g样品,加水溶解,配成250 mL溶液。
步骤Ⅱ用酸式滴定管量取25.00 mL样品溶液于 250 mL锥形瓶中,加入10mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液。用0.1010 mol·L-1的NaOH标准溶液滴定至终点。按上述操作方法再重复2次。?
250 mL锥形瓶中,加入10mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液。用0.1010 mol·L-1的NaOH标准溶液滴定至终点。按上述操作方法再重复2次。?
⑴根据实验步骤填空:
①步骤Ⅰ中用到的主要玻璃仪器有?;
②步骤Ⅱ中酸式滴定管用蒸馏水洗涤后,直接加入样品溶液进行量取,则测得样品中氮质量分数?(填“偏高”、“偏低”或“无影响”,下同)。锥形瓶用蒸馏水洗涤后,水未倒尽,则对滴定时用去NaOH标准溶液的体积?。滴定时对NaOH标准溶液体积,读取初读数时仰视,读取终读数时姿势正确,则测得样品中氮质量分数?。
③滴定时边滴边摇动锥形瓶,眼睛应观察?
A.滴定管内液面的变化?
B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由?色变成?色。
⑵滴定结果如表所示:
滴定次数
| 待测溶液体积/ml
| 标准NaOH溶液体积读数(ml)
|
滴定前/ml
| 滴定后/ml
|
1
| 25.00
| 1.02
| 21.03
|
2
| 25.00
| 2.00
| 21.99
|
3
| 25.00
| 2.30
| 22.30
|
则消耗NaOH标准溶液的体积平均为?,该样品中氮的质量分数为?。