1、推断题 下图是一些常见的单质和化合物之间的转化关系图,有些反应中的部分物质被略去。常温常压下,A为无色有毒气体,B为红棕色粉末,C、E为生活中最常用的金属单质,J为红褐色固体,L为两性氢氧化物。反应①、②均为工业上的重要反应。
请回答下列问题:?
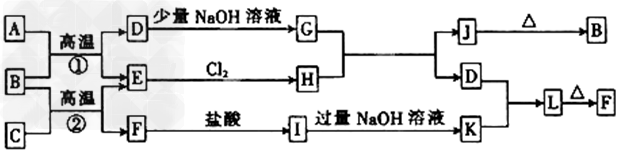
(1)写出B的化学式为_________;D的电子式为______________。?
(2)组成单质C的元素在元素周期表中的位置为_________________;
(3)写出向I溶液中加入过量NaOH溶液时发生反应的离子方程式____________________。
(4)写出向Na2SiO3溶液中通入少量D时发生反应的离子方程式___________________。
参考答案:(1)Fe2O3;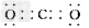
(2)第三周期IIIA族
(3)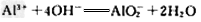
(4)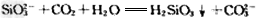
本题解析:
本题难度:一般
2、填空题 (6分)已知物质A、B、C、D、E、F、G、H、I、J、X、Y有如下图所示的转化关系,其中气体A、B、C为常见非金属单质,X、Y为常见金属单质。(部分反应中生成物没有全部列出,反应条件未全部列出)

请按要求回答下列问题:
(1)气体E的电子式为?;
(2)G的化学式是___________;
(3)写出反应“I→J”的离子方程式?;
(4)金属X与NaOH溶液反应也能得到溶液H,试写出对应的化学方程式?。
参考答案:(6分)(1)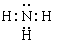 (2)Al(OH)3
(2)Al(OH)3
(3)2Fe2++Cl2=2Fe3++2Cl-?(4)2Al+2NaOH+2H2O=2NaAlO2+3H2↑
本题解析:溶液D能和二氧化锰在加热的条件下生成气体,这说明D应该是浓盐酸,C是氯气。金属Y能和盐酸反应生成溶液I,而I能和氯气继续反应,这说明Y应该是变价的金属,即Y是铁,则I是氯化亚铁,J是氯化铁。B和氯气反应生成氯化氢,所以B是氢气。白色沉淀G能溶于氢氧化钠溶液中,说明G是氢氧化铝,则X是Al,F是氯化铝。F能和E反应生成氢氧化铝,且E是气体,所以E是氨气,则A是氮气。
点评:该题是中等难度的试题,试题综合性强,侧重能力的培养和解题方法的训练,有利于培养学生的逻辑推理能力和创新思维能力。该题的需要学生明确的是化学推断题是一类综合性较强的试题,如元素及化合物性质和社会生活,环境保护,化学计算等知识,还可引入学科间综合。它不仅可考察学生对化学知识的理解程度,更重要的是培养学生的综合分析能力和思维方法。解框图题的方法:最关键的是寻找“突破口”,“突破口”就是抓“特”字,例如特殊颜色、特殊状态、特殊气味、特殊反应、特殊现象、特殊制法、特殊用途等。
本题难度:困难
3、选择题 今有甲、乙、丙、丁、戊5种物质,在一定条件下,它们能按下图方式进行转化:
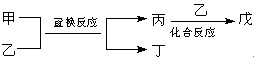
其推断正确的是
选项
| 甲
| 乙
| 丙
| 丁
| 戊
|
A
| NH3
| O2
| NO
| H2O
| NO2
|
B
| Mg
| CO2
| C
| MgO
| CO
|
C
| C
| H2O
| CO
| H2
| HCOOH
|
D
| FeBr2
| Cl2
| FeCl2
| Br2
| FeCl3
|
?
参考答案:B
本题解析:A项不符合置换反应类型,错误;B项正确;C项中CO和氢气不能化合生成戊,错误;D项中若发生置换反应,生成丙应该是三价铁离子,错误;选择B。
本题难度:简单
4、填空题 已知A、B为常见的金属单质,C、D为常见的非金属单质,甲、乙、丙为三种常见的化合物,甲是中学化学中常见的红棕色粉末状固体,它们之间的相互转化关系如图所示(部分产物及反应条件没有列出):
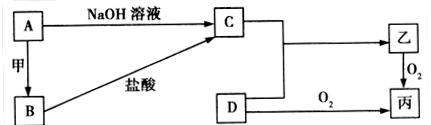
(1)写出框图中A转化为B的化学方程式:_______________________________________,该反应属于______________(填“吸热反应”或“放热反应”)。
(2)若乙的水溶液呈弱酸性,丙是一种大气污染物、有刺激性气味。已知16 g固体单质D完全燃烧转化成丙时,放出148.4 kJ的热量,则该反应的热化学方程式为:
_____________________________________________________________________________。
(3)若乙在水溶液中呈弱碱性,其盐可用作化肥,且C与D化合生成乙的反应是可逆反应。
①将等物质的量的C、D两种单质充入一体积恒定的密闭容器中,在适当催化剂和恒温条件下反应,下列说法中不正确的是____________(填字母)。
a.达到化学平衡时,2υ正(C) = 3υ逆(乙)
b.反应过程中,D单质的体积分数始终为50%
c.达到化学平衡时,混合气体的密度保持不变
d.达到化学平衡的过程中,气体的平均相对分子质量逐渐增大
e.达到化学平衡后,再升高温度,乙的体积分数增大
②若在一个体积为10 L的密闭容器中,充入8 mol C单质和2 mol D单质,在一定温度下发生反应生成气体乙,经40 min后反应达到平衡,此时C的转化率为37.5%。从反应开始到达平衡的40 min内,用物质乙表示的化学反应速率为_________________________;达到平衡后,若向容器中按5∶1∶2的物质的量之比再次充入C、D、乙三种物质,则原平衡体系中C的转化率将_____________(填“增大”、“减小”或“不变”)。
参考答案:(1)2Al + Fe2O3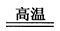 ? Al2O3 + 2Fe(2分)?放热反应(1分)
? Al2O3 + 2Fe(2分)?放热反应(1分)
(2)S(s) + O2(g) = SO2(g);△H ="–296.8" kJ/mol (2分)
(3)①e (2分)? ②0.005 mol/(L?min) (2分)?增大 (1分)
本题解析:略
本题难度:简单
5、简答题 将黑色固体单质甲灼烧后投入D的浓溶液中,两者剧烈反应生成气态混合物A,隔绝空气按如图所示发生一系列转化.
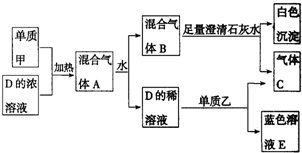
请回答下列问题:
(1)气体C是______,溶液E的溶质是______(用化学式表示).
(2)写出单质甲与D的浓溶液反应的化学方程式______.
(3)写出气体B通入足量澄清石灰水中发生反应的离子方程式______.
参考答案:D的稀溶液与单质乙反应可以得到蓝色溶液E,则E溶液含有铜离子,结合转化关系可知,乙为Cu、D为硝酸,故E为Cu(NO3)2,反应生成的C为NO.
黑色固体单质甲与浓硝酸反应得到混合气体A,A溶于水得到稀硝酸与混合气体B,B与足量的石灰水反应得到白色沉淀与NO,则白色沉淀为CaCO3,B为CO2、NO混合气体,A为CO2、NO2混合气体,故甲为碳单质,
(1)由上述分析可知,气体C是NO,溶液E的溶质是Cu(NO3)2,
故答案为:NO;Cu(NO3)2;
(2)单质碳与浓硝酸反应的化学方程式为:C+4HNO3(浓)△.CO2↑+4NO2↑+2H2O,
故答案为:C+4HNO3(浓)△.CO2↑+4NO2↑+2H2O;
(3)气体B通入足量澄清石灰水中发生反应的离子方程式为:Ca2++CO2+2OH-═CaCO3↓+H2O,
故答案为:Ca2++CO2+2OH-═CaCO3↓+H2O.
本题解析:
本题难度:一般