1、选择题 下列实验设计能够成功的是( )
A.检验亚硫酸钠试样是否变质:试样 白色沉淀
白色沉淀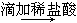 沉淀不溶解―→说明试样已变质
沉淀不溶解―→说明试样已变质
B.除去粗盐中含有的硫酸钙杂质粗盐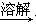
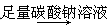
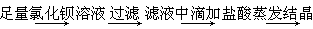 精盐
精盐
C.检验某溶液中是否含有Fe2+试样 溶液颜色无变化
溶液颜色无变化 溶液变红色―→溶液中含有Fe2+
溶液变红色―→溶液中含有Fe2+
D.证明酸性条件H2O2的氧化性比I2强:NaI溶液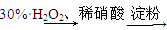 溶液变蓝色―→氧化性:H2O2>I2
溶液变蓝色―→氧化性:H2O2>I2
参考答案:C
本题解析:A项中加入硝酸钡溶液引入的NO3-和加入盐酸引入的H+能将SO32-氧化,错误;B项中引入了杂质氯化钡,错误;D项中硝酸具有强氧化性,也能将I-氧化为I2,应用盐酸或稀硫酸酸化,错误。
本题难度:一般
2、选择题 下列各组混合物中,都能用分液漏斗分离的是( )
A.乙酸乙酯和水酒精和水苯酚和水
B.二溴乙烷和水溴苯和水硝基苯和水
C.甘油和水已烷和水甲酸和水
D.苯和甲苯乙醛和水乙酸和乙醇
参考答案:A、乙酸乙酯和水不溶,酒精和水互溶,苯酚和水不溶,故A错误;
B、二溴乙烷和水不溶,溴苯和水不溶,硝基苯和水不溶,都能用分液漏斗分离,故B正确;
C、甘油和水互溶,已烷和水不溶,甲酸和水互溶,故C错误;
D、苯和甲苯互溶,乙醛和水互溶,乙酸和乙醇互溶,故D错误;
故选B.
本题解析:
本题难度:简单
3、填空题 随着不断向化工、石油、电力、海水淡化、建筑、日常生活用品等行业推广,钛金属日益被人们重视,被誉为“现代金属”和“战略金属”,是提高国防装备水平不可或缺的重要战略物资。工业主要以二氧化钛为原料冶炼金属钛。
Ⅰ.二氧化钛可由以下两种方法制备:
方法1:可用含有Fe2O3的钛铁矿(主要成分为FeTiO3,其中Ti元素化合价为+4价)制取,其主要流程如下:
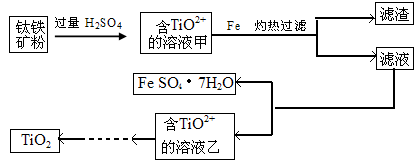
(1)由滤液获得绿矾晶体的操作过程是?。
(2)甲溶液中除含TiO2+之外还含有的金属阳离子有?。
(3)已知10kg该钛铁矿中铁元素的质量分数为33.6%,能够得到绿矾晶体22.24kg,试计算最少加入铁粉的质量。
方法2:TiCl4水解生成TiO2·XH2O,过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2,此方法制备得到的是纳米二氧化钛。
(4)①TiCl4水解生成TiO2·XH2O的化学方程式为?。
②检验TiO2·XH2O中Cl-是否被除净的方法是?。
Ⅱ.二氧化钛可用于制取钛单质
(5)TiO2制取单质Ti,涉及到的步骤如下:
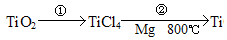 ?
?
反应②的化学方程式是?,该反应成功需要的其他条件及原因是?。
参考答案:
(1)冷却、结晶、过滤
(2)Fe3+ 、Fe2+
(3)1.12kg
(4)①TiCl4 + (x+2)H2O(过量) TiO2·xH2O↓ + 4HCl
TiO2·xH2O↓ + 4HCl
②取最后一次洗涤液少量,滴加硝酸酸化的AgNO3溶液,不产生白色沉淀,说明Cl-已除净。
(5) ?稀有气体保护,防止高温下Mg(Ti)与空气中的O2(或CO2、N2)作用
?稀有气体保护,防止高温下Mg(Ti)与空气中的O2(或CO2、N2)作用
本题解析:(1)滤液中含有的溶质是FeSO4,要从中得绿矾晶体的操作过程是蒸发浓缩、冷却、结晶,最后过滤即得到固体就是绿矾。(2)钛铁矿中含有Fe2O3当加入过量的硫酸溶解时,Fe2O3与硫酸反应产生Fe2 (SO4)3,因此该溶液中含有的阳离子为Fe3+ 、Fe2+、TiO2+、H+。则除含TiO2+之外还含有的金属阳离子有Fe3+ 、Fe2+。(3)钛铁矿中铁元素的质量33.6%×10kg=3.36Kg.绿矾晶体22.24kg中含有的Fe元素的质量为22.24kg×(56÷278)=4.48Kg.所以加入的Fe元素的质量为4.48Kg-3.36Kg="1.12Kg." (4)①TiCl4水解生成TiO2·XH2O的化学方程式为TiCl4 + (x+2)H2O(过量) TiO2·xH2O↓ + 4HCl. ②检验TiO2·XH2O中Cl-是否被除净的方法是取最后一次洗涤液少量,滴加硝酸酸化的AgNO3溶液,不产生白色沉淀,说明Cl-已除净。(5)根据题意和已知条件可得反应的方程式为
TiO2·xH2O↓ + 4HCl. ②检验TiO2·XH2O中Cl-是否被除净的方法是取最后一次洗涤液少量,滴加硝酸酸化的AgNO3溶液,不产生白色沉淀,说明Cl-已除净。(5)根据题意和已知条件可得反应的方程式为 。因为Mg及反应产生的Ti容易与其它物质发生反应,为防止在高温下它们与空气中的氧气反应,所以该反应成功需要在稀有气体的环境中进行。2的制取方法及以TiO2为原料制取钛单质的反应原理、混合物的分离方法、反应条件的选择。
。因为Mg及反应产生的Ti容易与其它物质发生反应,为防止在高温下它们与空气中的氧气反应,所以该反应成功需要在稀有气体的环境中进行。2的制取方法及以TiO2为原料制取钛单质的反应原理、混合物的分离方法、反应条件的选择。
本题难度:一般
4、填空题 利用钛白工业的副产品FeSO4(含Al2(SO4)3和少量重金属离子)可以生产电池级高纯超微细草酸亚铁。其工艺流程如下:
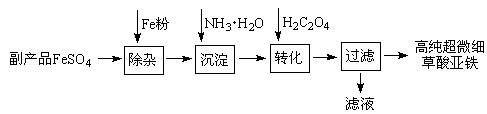
已知:①5Fe2++ MnO4-+8H+=5Fe3+ +Mn2++4H2O
5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O
(1)沉淀过程的反应温度为40℃,温度不宜过高的原因除了控制沉淀的粒径外,还有?。
(2)滤液经处理可得到副产品?。
(3)实验室测定高纯超微细草酸亚铁组成的步骤依次为:
步骤1:准确称量一定量草酸亚铁样品,加入25 mL 2 mol·L-1的H2SO4溶解。
步骤2:用0.2000 mol·L-1标准KMnO4溶液滴定,消耗其体积30.40 mL。
步骤3:向滴定后的溶液中加入2 g Zn粉和5 mL 2 mol·L-1的H2SO4溶液,将Fe3+还原为Fe2+。
步骤4:过滤,滤液用上述标准KMnO4溶液滴定,消耗溶液10.00 mL。
则样品中C2O42-的物质的量为?。(写出计算过程)
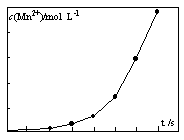
(4)将一定量高锰酸钾溶液与酸化的草酸亚铁溶液混合,测得反应 液中Mn2+的浓度随反应时间t的变化如图,其变化趋势的原因可能为?。
参考答案:(1)NH3?H2O受热易分解,挥发出NH3,Fe(OH)2受热易分解。(2分)
(2)(NH4)2SO4(2分)
(3)解:由题意知,C2O42-消耗KMnO4溶液体积为(30.40-10.00)=20.4mL,
5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O
5? 2
n?20.4×10-3×0.2000mol
解得? n=0.0102mol? (4分)
(4)生成的Mn2+作催化剂,随着Mn2+浓度增加,反应速率越来越快。(2分)
本题解析:(1)温度不宜过高的原因除了控制沉淀的粒径外,还有NH3?H2O受热易分解,挥发出NH3,Fe(OH)2受热易分解
(2)沉淀步骤中加入一水合氨,生成氢氧化亚铁沉淀的同时还有硫酸铵生成,所以副产品是(NH4)2SO4
(3)由题意知氧化C2O42-和Fe2+共消耗0.2000 mol·L-1标准KMnO4溶液体积30.40 mL,步骤3、4标准KMnO4溶液只氧化Fe2+消耗KMnO4溶液体积10.00mL,所以C2O42-消耗KMnO4溶液体积为(30.40-10.00)=20.4mL,由5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O得5C2O42-~2MnO4-,所以C2O42-的物质的量为20.4×10-3×0.2000×5/2=0.0102mol;
(4)从图像上观察,随着反应对进行,曲线的斜率越来越大,说明单位时间内Mn2+的浓度越来越大,所以反应速率越来越快,反应中若温度不变,只能是生成的Mn2+作催化剂,随着Mn2+浓度增加,反应速率越来越快。
本题难度:一般
5、选择题 某溶液中含有Cl-、SO42-、Fe3+、K+、M,且离子物质的量之比为2:3:1:3:2,则微粒M可能为
A.Na+
B.Ag+
C.Ba2+
D.Mg2+
参考答案:A
本题解析:分析:某溶液中含有Cl-、SO42-、Fe3+、K+、M,,溶液不显电性,利用电荷守恒及离子的共存来计算解答.
解答:溶液中含有Cl-、SO42-、Fe3+、K+、M,且离子物质的量之比为2:3:1:3:2,
设M的电荷为x,
由电荷守恒可知,
2×1+3×2=1×3+3×1+x×2,
解得x=+1,
则C、D选项排除,又Ag+与Cl-、SO42-不能共存,
则M可能为Na+,
故选A.
点评:题考查物质的量的有关计算,明确电荷守恒、离子的共存是解答本题的关键,选项B为易错点,题目难度不大.
本题难度:简单