1、选择题 下列实验设计能够成功的是( )
A.检验亚硫酸钠试样是否变质:试样 白色沉淀
白色沉淀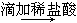 沉淀不溶解―→说明试样已变质
沉淀不溶解―→说明试样已变质
B.除去粗盐中含有的硫酸钙杂质粗盐
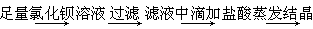 精盐
精盐
C.检验某溶液中是否含有Fe2+试样 溶液颜色无变化
溶液颜色无变化 溶液变红色―→溶液中含有Fe2+
溶液变红色―→溶液中含有Fe2+
D.证明酸性条件H2O2的氧化性比I2强:NaI溶液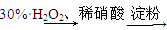 溶液变蓝色―→氧化性:H2O2>I2
溶液变蓝色―→氧化性:H2O2>I2
2、选择题 下列各组混合物中,都能用分液漏斗分离的是( )
A.乙酸乙酯和水酒精和水苯酚和水
B.二溴乙烷和水溴苯和水硝基苯和水
C.甘油和水已烷和水甲酸和水
D.苯和甲苯乙醛和水乙酸和乙醇
3、填空题 随着不断向化工、石油、电力、海水淡化、建筑、日常生活用品等行业推广,钛金属日益被人们重视,被誉为“现代金属”和“战略金属”,是提高国防装备水平不可或缺的重要战略物资。工业主要以二氧化钛为原料冶炼金属钛。
Ⅰ.二氧化钛可由以下两种方法制备:
方法1:可用含有Fe2O3的钛铁矿(主要成分为FeTiO3,其中Ti元素化合价为+4价)制取,其主要流程如下:
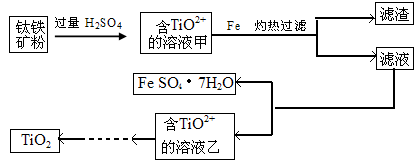
(1)由滤液获得绿矾晶体的操作过程是?。
(2)甲溶液中除含TiO2+之外还含有的金属阳离子有?。
(3)已知10kg该钛铁矿中铁元素的质量分数为33.6%,能够得到绿矾晶体22.24kg,试计算最少加入铁粉的质量。
方法2:TiCl4水解生成TiO2·XH2O,过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2,此方法制备得到的是纳米二氧化钛。
(4)①TiCl4水解生成TiO2·XH2O的化学方程式为?。
②检验TiO2·XH2O中Cl-是否被除净的方法是?。
Ⅱ.二氧化钛可用于制取钛单质
(5)TiO2制取单质Ti,涉及到的步骤如下:
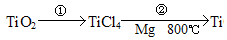 ?
?
反应②的化学方程式是?,该反应成功需要的其他条件及原因是?。
4、填空题 利用钛白工业的副产品FeSO4(含Al2(SO4)3和少量重金属离子)可以生产电池级高纯超微细草酸亚铁。其工艺流程如下:
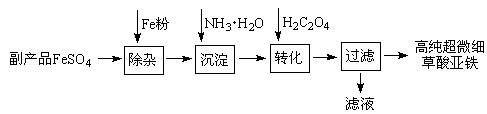
已知:①5Fe2++ MnO4-+8H+=5Fe3+ +Mn2++4H2O
5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O
(1)沉淀过程的反应温度为40℃,温度不宜过高的原因除了控制沉淀的粒径外,还有?。
(2)滤液经处理可得到副产品?。
(3)实验室测定高纯超微细草酸亚铁组成的步骤依次为:
步骤1:准确称量一定量草酸亚铁样品,加入25 mL 2 mol·L-1的H2SO4溶解。
步骤2:用0.2000 mol·L-1标准KMnO4溶液滴定,消耗其体积30.40 mL。
步骤3:向滴定后的溶液中加入2 g Zn粉和5 mL 2 mol·L-1的H2SO4溶液,将Fe3+还原为Fe2+。
步骤4:过滤,滤液用上述标准KMnO4溶液滴定,消耗溶液10.00 mL。
则样品中C2O42-的物质的量为?。(写出计算过程)
(4)将一定量高锰酸钾溶液与酸化的草酸亚铁溶液混合,测得反应 液中Mn2+的浓度随反应时间t的变化如图,其变化趋势的原因可能为?。
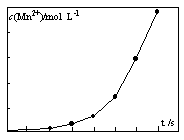
来源:91exam .org
5、选择题 某溶液中含有Cl-、SO42-、Fe3+、K+、M,且离子物质的量之比为2:3:1:3:2,则微粒M可能为
A.Na+
B.Ag+
C.Ba2+
D.Mg2+