1、选择题 冰箱除味剂的主要成分是活性炭,活性炭是黑色粉末或颗粒。下列说法不正确的是(?)
A.活性炭常用来净化某些气体或液体
B.用果壳、木材等炭化制备活性炭的过程只包含物理变化
C.使用过的活性炭经过处理可以反复使用
D.活性炭具有很强的吸附性,是因为活性炭具有疏松多孔的结构
参考答案:B
本题解析:本题考查活性炭的性质,主要是具有吸附性能,但经炭化制备活性炭主要发生化学变化。
本题难度:简单
2、选择题 美国科学家用有机分子和球形笼状分子C60首次制成了“纳米车”(如图),每辆“纳米车”是用一个有机分子和4个球形笼状分子“组装”而成。“纳米车”可以用来运输单个的有机分子,生产复杂的材料和药物,成为“纳米生产”中的有用工具。下列说法正确的是
A.我们可以直接用肉眼清晰地看到这种“纳米车”的运动
B.“纳米车”的诞生,说明人类操纵分子的技术进入一个新阶段
C.C60是一种新型化合物
D.C60熔点比金刚石熔点高
参考答案:B
本题解析:A错,纳米的数量级为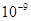 米,无法用肉眼观察;B正确;C错,C60是一种单质;D错,C60是分子晶体,而金刚石是原子晶体,原子晶体的熔点大于分子晶体;
米,无法用肉眼观察;B正确;C错,C60是一种单质;D错,C60是分子晶体,而金刚石是原子晶体,原子晶体的熔点大于分子晶体;
本题难度:一般
3、填空题 一定体积的二氧化碳被体积为V mL的氢氧化钠溶液完全吸收后,经检验发现溶液中的氢氧化钠已经完全反应。将上述反应后的液体分为两等份。
(1)甲同学向其中的一份加入足量的澄清石灰水,得到沉淀的质量为M g。据此,能否确定最初通入的CO2在标准状况下的体积?如果能,请列出计算式;如果不能,请在下面的横线上填写“不能”。
答:_________________________________________________________________________。
能否据此确定氢氧化钠溶液的浓度?如果能,请列出计算式;如果不能,请在下面的横线上填写“不能”。
答:___________________________________________________________________________。
(2)乙同学向第二份溶液中滴加足量的CaCl2溶液,最终得到干燥沉淀N g。据此判断M与N的相对大小关系是:__________________________________________________。
参考答案:(1)能? 2×22.4 L·mol-1×M g/100 g·mol-1(即0.448M L)?不能
(2)M≥N
本题解析:(1)由题意知,CO2与NaOH恰好完全反应,可能反应为:CO2+2NaOH====Na2CO3+H2O? CO2+NaOH====NaHCO3
向反应后的第一份溶液中加入足量澄清石灰水时,可能反应为:Na2CO3+Ca(OH)2====CaCO3↓+2NaOH,NaHCO3+Ca(OH)2====CaCO3↓+H2O+NaOH,根据上述四个反应方程式可得关系式:CO2—CaCO3↓。
第一份:n(CO2)=n(CaCO3)=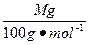 ,最初通入的CO2体积为:V(CO2)="2×22.4" L·mol-1×M g/100 g·mol-1="0.448M" L。
,最初通入的CO2体积为:V(CO2)="2×22.4" L·mol-1×M g/100 g·mol-1="0.448M" L。
由于不知道NaOH的物质的量,故不能确定NaOH溶液的浓度。
(2)向第二份溶液中滴加足量的CaCl2溶液时,由于溶液中可能只有Na2CO3,也可能是Na2CO3与NaHCO3的混合溶液,故只发生反应CaCl2+Na2CO3====CaCO3↓+2NaCl,所以M≥N。
本题难度:简单
4、选择题 下列表述不正确的是(? )
A.常温下,SiO2性质较稳定,不与所有的酸发生反应
B.硅酸钠的水溶液俗称水玻璃,可作防火材料
C.硅是一种亲氧元素,在地壳中的含量仅次于氧
D.玻璃、陶瓷、水泥都属于硅酸盐产品
参考答案:A
本题解析:常温下,SiO2性质较稳定但是可以和HF酸反应,A错误。硅酸钠的水溶液俗称水玻璃,是一种粘胶,可作防火材料。自然界在元素含量为氧、硅、铝、铁,硅在地壳中的含量仅次于氧。
本题难度:简单
5、选择题 根据碳族元素的相似性与递变性、一般性与特殊性的知识,判断下列说法正确的是(? )
A.CO2、PbO2都是强氧化剂
B.CO2和PbO2都是弱氧化剂,CO和PbO都是还原剂
C.Sn(OH)4可与NaOH反应,但不与盐酸反应
D.Ge单质的熔点介于Si、Pb之间,是半导体材料
参考答案:D
本题解析:碳族元素中,C、Si、Ge、Sn的+4价化合物稳定,而Pb的+2价化合物稳定,+4价不稳定的元素表现强氧化性,+2价不稳定的元素则表现强还原性,故A、B都错。Sn是典型金属,所以其最高价氧化物对应的水化物Sn(OH)4和HCl易反应,碳族元素单质的熔沸点由上而下逐渐降低,故D正确。
本题难度:一般