1、选择题 复合材料的优点是:①强度高? ②质量轻? ③耐高温? ④耐腐蚀
A.仅 ①②
B.仅 ②③
C.仅③④
D.全部
参考答案:D
本题解析:复合材料继承了原来天然材料、无机非金属材料、金属材料、有机合成材料等优点,极大改善了材料各种性能。具有强度高,质量轻,耐高温,耐腐蚀等特性。
本题难度:一般
2、选择题 以下物质间的每步转化通过一步反应能实现的是
A.Al-Al2O3-Al(OH)3-NaAlO2
B.Fe-FeO-Fe(OH)2-Fe(OH)3
C.Si-SiO2-H2SiO3-Na2SiO3
D.Na-Na2O2-Na2CO3-NaOH
参考答案:D
本题解析:试题分析:A中氧化铝不能一步生成氢氧化铝,A错误;B中氧化亚铁不能一步生成氢氧化亚铁,B错误;C中二氧化硅不能一步生成硅酸,C错误。
考点:物质的转化
点评:氧化铝、氧化铜、氧化铁不能与水反应生成相应的碱;二氧化硅不能与水生成硅酸;硫与氧气不能生成三氧化硫;氮气与氧气不能生成二氧化氮。
本题难度:简单
3、选择题 有A、B、C、D四块金属片,进行如下实验:①A、B用导线相连后,同时浸入稀H2SO4溶液中,A极为负极;②C、D用导线相连后,同时浸入稀H2SO4溶液中,外电路电流由D到C;③A、C用导线相连后,同时浸入稀H2SO4溶液中,C极产生大量气泡;④B、D用导线相连后,同时浸入稀H2SO4溶液中,D极发生氧化反应。据此,判断四种金属的活动性顺序是
A.A>C>D>B
B.A>B>C>D
C.C>A>D>B
D.C>B>D>A
参考答案:A
本题解析:在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。根据①可知金属性是A大于B;根据②可知金属性是C大于D;根据③可知金属性A大于C;根据④可知金属性是D大于B,所以答案选A。
本题难度:一般
4、选择题 下列现象或事实可用同一原理解释的是
A.浓硫酸和浓盐酸长期暴露在空气中浓度均降低
B.氯气和二氧化硫均能使品红溶液褪色
C.乙炔和乙烯使溴的四氯化碳溶液褪色
D.漂白粉和水玻璃长期暴露在空气中均会变质
参考答案:C
本题解析:分析:A.浓硫酸有吸水性,浓盐酸有挥发性;
B.次氯酸有强氧化性,二氧化硫和有色物质反应生成无色物质;
C.含有碳碳双键或碳碳三键的有机物能和溴发生加成反应;
D.漂白粉中次氯酸钙和二氧化碳、水反应生成碳酸钙和次氯酸,次氯酸不稳定生成盐酸和氧气,硅酸钠和二氧化碳、水反应生成硅酸.
解答:A.浓硫酸的吸水性使浓硫酸中溶剂的量增大,溶质的量不变,导致浓度降低,浓盐酸有挥发性,使溶质的量减少,溶剂的量不变,导致浓度降低,所以浓硫酸和浓盐酸浓度降低的原因不同,故A不符合;
B.氯气和水反应生成具有强氧化性的次氯酸,次氯酸氧化品红溶液而失去褪色,二氧化硫和品红溶液反应生成无色物质而使其褪色,所以褪色原理不变,故B不符合;
C.乙烯含有碳碳双键 ,乙炔含有碳碳三键,所以它们都能和溴发生加成反应而使其褪色,故C符合;
D.Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3,硅酸钠和二氧化碳、水反应属于复分解反应,漂白粉变质Ca(ClO)2+CO2+H2O=CaCO3+2HClO,2HClO 2HCl+O2↑涉及复分解反应和氧化还原反应,所以两个反应原理不同,故D不符合;
2HCl+O2↑涉及复分解反应和氧化还原反应,所以两个反应原理不同,故D不符合;
故选C.
点评:本题考查元素化合物的性质,根据物质的性质来分析解答即可,注意二氧化硫能使品红溶液褪色,但不能使酸碱指示剂褪色.
本题难度:简单
5、选择题 把9.2g Na和4.2g Si同时投入适量水中,在标准状况下产生H2的体积是
A.2.8 L
B.5.6 L
C.11.2 L
D.22.4 L
参考答案:C
本题解析:n(Na)=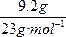 ="0.4" mol,由2Na+2H2O
="0.4" mol,由2Na+2H2O![]() 2NaOH+H2↑,可知产生0.4 mol? NaOH和0.2 mol H2,n(Si)=
2NaOH+H2↑,可知产生0.4 mol? NaOH和0.2 mol H2,n(Si)= 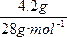 ="0.15" mol,由2NaOH+Si+H2O
="0.15" mol,由2NaOH+Si+H2O![]() Na2SiO3+2H2↑知NaOH过量,Si与NaOH溶液反应产生H2 0.3 mol,故共产生H2 0.5 mol。
Na2SiO3+2H2↑知NaOH过量,Si与NaOH溶液反应产生H2 0.3 mol,故共产生H2 0.5 mol。
本题难度:困难