1、计算题 (8分)将15.68L(标准状况)的氯气通入70℃.500mL氢氧化钠溶液中,发生了两个自身氧化还原反应,其氧化产物为次氯酸钠和氯酸钠。若取此溶液25mL,稀释到250mL,再取稀释后的溶液25mL用醋酸酸化后,加入过量碘化钾溶液充分反应,此时只有次氯酸钠氧化碘化钾。用浓度为0.20mol/L硫代硫酸钠(Na2S2O3)测定析出的碘:I2+2Na2S2O3=2NaI+Na2S4O6,需用硫代硫酸钠溶液5.0mL。将上述测定后的溶液再用盐酸调至强酸性,此时氯酸钠亦能氧化碘化钾,析出的碘再用上述硫代硫酸钠测定,又用了30.0mL。
(1)计算反应后溶液中次氯酸钠和氯酸钠的物质的量之比。
(2)用一个总化学方程式表示题中氯气通入70℃氢氧化钠溶液中所发生的化学反应。
(3)假设题中氢氧化钠溶液的体积在通入氯气前后的变化可忽略不计,请计算通入氯气后各生成物的物质的量浓度。
参考答案:(8分)(1)n(NaClO)︰n(NaClO3)=1︰2?(3分)
(2)7Cl2+14NaOH=NaClO+2NaClO3+11NaCl+7H2O?(2分)
(3)c(NaClO)=0.2mol/L? c(NaClO3)=0.4moL/L? c(NaCl)=2.2mol/L(3分)
本题解析:
⑴ 根据题意,有:
ClO-~2I-~I2~2S2O32-?ClO3-~6I-~3I2~6S2O32-
1mol? 2mol? 1mol? 6mol
0.0005? 0.20×0.005? 0.001? 0.20×0.03
因此,n(ClO-)∶n(ClO3-)=0.0005∶0.001=1∶2,即反应后溶液中次氯酸钠与氯酸钠的物质的量之比为1∶2。
⑵根据计算结果,得总的化学方程式为:7Cl2+14NaOH=11NaCl+NaClO+2NaClO3+7H2O
⑶通入氯气后,n(NaClO)=0.0005mol×250mL/25mL=0.005mol,因此c(NaClO)=0.005mol/(25mL×10-3L?mL-1)=0.2mol·L-1。
根据总反应的化学方程式中各物质的物质的量的关系,得
c(NaClO3)=2c(NaClO)=2×0.2mol·L-1=0.4mol·L-1,
c(NaCl)=11c(NaClO)=11×0.2mol·L-1=2.2mol·L-1。
本题难度:一般
2、选择题 突发事件中,我们要善于利用学过的知识,采取科学、有效的方法保护自己.某大型化工厂发生氯气泄漏,以下措施合理的是( )
A.在厂区多放几盆水即可
B.向地势低的地方撤离
C.观察风向,顺风撤离
D.用浸有水或弱碱性溶液的毛巾捂住口鼻撤离
参考答案:A、氯气是有毒气体,且氯气的溶解性较小,所以发生氯气泄漏时,多放几盆水不能解决问题,故A错误;
B、氯气的密度大于空气的密度,所以和空气混合时,氯气在下方,空气在上方,所以发生氯气泄漏时,不能向地势低的地方撤离,故B错误;
C、观察风向,应该逆风撤离,故C错误;
D、氯气和水、碱性物质反应降低毒性,所以可以用浸有水或弱碱性溶液的毛巾捂住口鼻撤离,故D正确;
故选D.
本题解析:
本题难度:一般
3、实验题 如图是某研究性学习小组设计制取氯气并以氯气为反应物进行特定反应的装置。
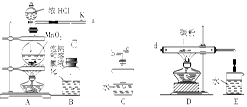
(1)要将C装置接入B和D之间,正确的接法是:a→?→?→d。
(2)实验开始先点燃A处的酒精灯,打开阀K,让Cl2充满整个装置,再点燃D处的酒精灯。Cl2通过C装置后进入D,D装置内盛有碳粉,发生氧化还原反应,生成CO2和HCl(g),发生反应的化学方程式为?。
(3)D处反应完毕后,关闭阀K,移去两个酒精灯,由于余热的作用,A处仍有少量Cl2产生,此时B中的现象是?,B的作用是?。
(4)在A、B 、C、D、E装置中有一处需要改进,说明需要改进的理由并画出改进后的装置图。
参考答案:(1)c b
(2)2Cl2+C+2H2O 4HCl+CO2
4HCl+CO2
(3)瓶中液面下降,长颈漏斗内液面上升 贮存少量Cl2,避免Cl2对环境造成污染
(4)D中反应生成的HCl气体极易溶于水,易发生倒吸

本题解析:正确连接的关键是C装置的作用,由于D中反应生成了CO2和HCl,有氢元素存在,说明有水参加反应,反应方程式为2Cl2+C+2H2O 4HCl+CO2,C装置的作用是提供水蒸气,而且Cl2从C中出来带出水蒸气,因此应该是长进短出。阀K关闭,此时B相当于量气装置,生成的气体将B中水压入漏斗中。由于D中反应生成了极易溶于水的HCl,E装置不正确,会造成E中水倒吸,可以用一个倒置的小漏斗防止倒吸。
4HCl+CO2,C装置的作用是提供水蒸气,而且Cl2从C中出来带出水蒸气,因此应该是长进短出。阀K关闭,此时B相当于量气装置,生成的气体将B中水压入漏斗中。由于D中反应生成了极易溶于水的HCl,E装置不正确,会造成E中水倒吸,可以用一个倒置的小漏斗防止倒吸。
本题难度:一般
4、填空题 (8分)
(1)将SO2和Cl2分别通入装有品红溶液的两个试管中,两溶液的红色均褪去。加热后,有一支试管中的溶液又呈现红色,该试管通入的气体是?,该实验说明的问题是?。
(2)将SO2和Cl2按1:1体积比(同温同压)混合后通入品红溶液中,溶液不褪色。为检验两种气体在溶液中是否发生了氧化还原反应,应向所得溶液加入的试剂是?(填化学式)。经实验证明,SO2和Cl2在溶液中发生了氧化还原反应,且SO2被氧化,该反应的离子方程式是?。
参考答案:(1)SO2;SO2与有色物质结合成的无色物质不稳定
(2)氯化钡溶液。SO2+C12+2H2O=4H++SO42-+2Cl-
本题解析:(1)二氧化硫和有色物质化合生成不稳定无色物质,加热后又可恢复;氯气漂白是靠的强氧化性,将有色物质氧化成无色物质,且过程不可恢复。
(2)SO2+C12+2H2O=4H++SO42-+2Cl-,检查有无硫酸根生成,来证明是否发生氧化还原!用可溶性钡盐来检验硫酸根的存在!
本题难度:一般
5、填空题 (12分)在新制的氯水参加的反应中,有如下几种情况:
(1)向KBr溶液中加入氯水,氯水中起作用的主要微粒是?,
反应的离子方程式是?。
(2)向AgNO3溶液中加入氯水,氯水中起作用的主要微粒是?,
反应的离子方程式是?。
(3)向氯水中滴加石蕊试液,溶液变红,起作用的微粒是?,然后又褪色,起作用的微粒是?,
参考答案:(1)Cl2? 2Br-+ Cl2 =2Cl-+Br2?(1分、3分)
(2)Cl-? Ag++Cl-=AgCl↓?(1分、3分)
(3)H+? HclO?(各2分)
本题解析:略
本题难度:一般