| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点讲解《物质的量》考点预测(2020年强化版)(十)
参考答案:B 本题解析:溶液的体积不一定是1L,不能根据物质的量浓度乘以溶液的体积求碳酸钠的物质的量,也不能求钠离子的物质的量,故A选项错误;标准状况下气体摩尔体积为22.4L/mol,可以根据气体体积除以气体摩尔体积求出甲烷的物质的量为1mol,由于1个甲烷分子具有10个质子,则1mol甲烷分子含有10mol质子,故B选项正确;乙烯中碳元素质量分数为6/7,丙烯中碳元素质量分数为6/7,则混合气体中碳元素质量分数为6/7,28g混合气体中含有24g碳原子,根据碳原子的质量除以碳原子的摩尔质量可以求出碳原子的物质的量为2mol,故C选项错误;常温常压下气体摩尔体积大于22.4L/mol,可以根据气体体积除以气体摩尔体积求出氯气的物质的量小于1.5mol,由于2Al+3Cl2=2AlCl3~6e—中氯气与转移电子的系数之比等于物质的量之比,则转移电子小于3mol,故D选项错误。 本题难度:一般 2、选择题 在相同条件下,下列各组物质中,分子数一定相同的是 |
参考答案:A
本题解析:
试题解析:34gNH3的物质的量=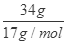 =2mol,4g氢气的物质的量=
=2mol,4g氢气的物质的量=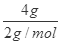 =2mol,二者物质的量相等,含有分子数目一定相等,故A正确;14gN2的物质的量=
=2mol,二者物质的量相等,含有分子数目一定相等,故A正确;14gN2的物质的量= =0.5mol,32gO2的物质的量
=0.5mol,32gO2的物质的量
本题难度:一般
3、选择题 阿伏加德罗常数约为6.02×1023 mol-1,下列说法中一定正确的是(?)
A.3.4gNH3含共价键的数目约为0.2×6.02×1023个
B.l L 0.5mol/L碳酸钠溶液中含有0.5×6.02×1023个CO32-
C.标准状况下,22.4 L SO2与11.2 L O2,混合充分反应,可得6.02×1023个SO3分子
D.6.4g Cu投入300 mL 10mol/L的浓硝酸中,充分反应后转移0.2×6.02×1023个电子
参考答案:D
本题解析:A:3.4gNH3含共价键的数目约为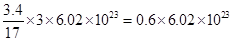 个;B:碳酸钠溶液中的CO32-部分水解;C:2SO2+O2
个;B:碳酸钠溶液中的CO32-部分水解;C:2SO2+O2 2SO3,可逆反应不可能全部进行到底;D:每个铜失去两个电子,所以6.4g Cu充分反应后推动的电子数必为0.2×6.02×1023个,答案为D
2SO3,可逆反应不可能全部进行到底;D:每个铜失去两个电子,所以6.4g Cu充分反应后推动的电子数必为0.2×6.02×1023个,答案为D
本题难度:一般
4、计算题 利用氨氧化法制硝酸,继而制取硝酸铵。若氨氧化法制硝酸的利用率为90%,氨转化为硝酸铵的转化率为94%。则100 t氨最多可生产多少吨硝酸铵?
参考答案:100 t氨最多可生成216.4 t硝酸铵。
本题解析:氨氧化法制硝酸的反应为:
4NH3+5O2 4NO+6H2O
4NO+6H2O
2NO+O2=2NO2
4NO2+2H2O+O2=4HNO3
所以氨氧化制硝酸的关系式为:
NH3~NO~NO2~HNO3(NH3全部转化为HNO3)
设生产硝酸的质量为x,用于生成HNO3的NH3质量为y生成NH4NO3的质量为z
NH3~NO~NO2~HNO3
17 63
y×90% x
y=
? NH3+HNO3=NH4NO3
17 63 80 ×94% x z
×94% x z
则17∶ =63∶x
=63∶x
x≈170.4 t
又63∶x=80∶z
z= =
= ≈216.4 t
≈216.4 t
本题难度:一般
5、选择题 与30mL?1mol/L的MgCl2溶液中Cl-浓度相同的是( )
A.150mL?0.2mol/L?FeCl2溶液
B.90mL?2mol/L?NaCl溶液
C.60mL?1mol/LAlCl3溶液
D.30mL?0.5mol/L?CaCl2溶液
参考答案:1mol/L的MgCl2溶液中Cl-浓度为2mol/L,
A、150mL?0.2mol/L?FeCl2溶液中Cl-浓度为0.2mol/L×2=0.4mol/L,故A不符合;
B、90mL?2mol/L?NaCl溶液中Cl-浓度为2mol/L×1=2mol/L,故B符合;
C、60mL?1mol/LAlCl3溶液中Cl-浓度为1mol/L×3=3mol/L,故C不符合;
D、30mL?0.5mol/L?CaCl2溶液中Cl-浓度为0.5mol/L×2=1mol/L,故D不符合;
故选B.
本题解析:
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点整理《氯及其化合.. | |