CuCl2
参考答案:D
本题解析:根据反应的方程式可知,锌失去电子,铜离子得到电子,所以如果构成原电池,则负极材料是锌,正极材料的金属性要弱于锌的,而电解质是含有铜离子的溶液,所以正确的答案选D。
点评:在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应,据此可以进行有关的判断和计算。
本题难度:一般
2、选择题 肼(N2H4)—空气燃料电池是一种环保型碱性燃料电池,电解质溶液是20%~30%的KOH溶液。电池总反应为:N2H4+O2=N2↑+2H2O。下列关于该燃料电池工作时的说法正确的是
A.负极的电极反应式是:N2H4+4OH--4e-=4H2O+N2↑
B.正极的电极反应式是:O2+4H++4e-=2H2O
C.溶液中阴离子向正极移动
D.用该电池电解AgNO3溶液,阴极每析出21.6gAg,负极会析出气体1.12L(标准状况,不考虑气体的溶解)
参考答案:AD
本题解析:原电池中负极失去电子,所以根据总反应式可知,肼是还原剂,在负极反应,A正确;氧气得到电子,在正极通入,但溶液是氢氧化钾,所以B不正确;原电池中阳离子向正极移动,阴离子向负极移动,C不正确;21.6g银是0.2mol,转移电子是0.2mol。所以根据电子的得失守恒可知,负极生成0.2mol÷4=0.05mol,标准状况下的体积是1.12L,D正确,答案选AD。
本题难度:一般
3、简答题 如图所示装置
(1)若烧杯中为稀H2SO4,两极反应式为:
正极______
负极______
总反应方程式______
(2)若烧杯中为NaOH溶液,总反应方程式为:______.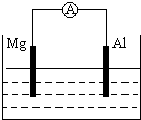
参考答案:(1)Mg、Al都和稀硫酸反应,但Mg失电子的能力大于?Al,所以Mg作负极,Al作正极,负极上Mg失电子变成离子进入溶液,所以电极反应式为:Mg-2e-=Mg2+.正极上氢离子得电子生成氢气,所以电极反应式为2H++2e-=H2↑;正负极上的电极反应式相加即得电池反应式,所以电池反应式为Mg+H2SO4=MgSO4+H2↑.
故答案为:正极2H++2e-=H2↑
? 负极Mg-2e-=Mg2+
?总Mg+H2SO4=MgSO4+H2↑
(2)Al和氢氧化钠溶液反应,Mg和氢氧化钠溶液不反应,Al失电子和氢氧根离子生成偏铝酸根离子和水,即Al-3e-+4?OH-=AlO2-+2?H2O,所以?Al作负极发生氧化反应;
Mg作正极,正极上水得电子生成氢气和氢氧根离子,发生还原反应,正极上的电极反应式为
6H2O+6e-=6OH-+3H2↑
所以电池反应式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑
本题解析:
本题难度:一般
4、填空题 某兴趣小组为了提高电池的效率,设计了下图所示的原电池。

请回答下列问题:
(1)若X是AlCl3溶液,Y是稀硫酸,请你写出电极名称及电极反应:
Al片( ) ____________________________,?
Cu片( ) ____________________________。?
(2)若X是浓硝酸,Y是NaCl溶液,请你写出电极名称及电极反应:
Al片( ) ____________________________,?
Cu片( ) ____________________________。?
参考答案:(1)负极 2Al-6e- 2Al3+ 2Al3+
正极 6H++6e- 3H2↑ 3H2↑
(2)正极 2N+4H++2e- 2NO2↑+2H2O 2NO2↑+2H2O
负极 Cu-2e- Cu2+ Cu2+
本题解析:(1)若X是AlCl3溶液,Y是稀硫酸,实质是由Al—稀硫酸—Cu组成的原电池,由于Al比Cu活泼,所以Al为负极,失电子,被氧化为Al3+,Cu为正极,溶液中的H+得电子,被还原为H2。
(2)若X是浓硝酸,Y是NaCl溶液,实质是由Al—浓硝酸—Cu组成的原电池,由于Al遇浓硝酸钝化,不能溶解,Al为正极,Cu为负极,失电子,被氧化为Cu2+。
本题难度:一般
5、选择题 氢氧燃料电池已用于航天飞机.以30%KOH溶液为电解质溶液的这种电池在使用时的电极反应如下:2H2+4OH--4e-=4H2O,O2+2H2O+4e-=4OH-?据此作出判断,下列说法中错误的是( )
A.H2在负极发生氧化反应
B.供电时的总反应为:2H2+O2=2H2O
C.产物为无污染的水,属于环境友好电池
D.燃料电池的能量转化率可达100%
参考答案:A、由电极反应式可知,通入氢气的一极为电池的负极,发生氧化反应,故A正确;
B、电池总反应与氢气在氧气中燃烧的化学方程式一致,供电时的总反应为2H2+O2═2H2O,故B正确;
C、氢氧燃料电池产物是水,对环境物污染,且能量转化率高,故C正确;
D、氢氧燃料电池是将化学能转变为电能的装置,还会伴有热能等能量的释放,能量转化率不会达100%,故D错误.
故选D.
本题解析:
本题难度:简单
|