1、选择题 对于锌铜和稀硫酸构成的原电池的电极名称叙述有错误的是
[? ]
A.发生氧化反应的为负极?
B.正极为电子流入的一极
C.比较不活泼的金属铜为负极?
D.电流的方向由正极到负极
参考答案:C
本题解析:
本题难度:一般
2、选择题 氢氧燃料电池可同时供应电和水蒸气,所用燃料为H2,电解质为熔融的K2CO3。已知该电池的正极反应为:O2+2CO2+4e-=2C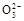 。下列叙述正确的是(?)
。下列叙述正确的是(?)
A.放电时C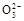 向正极移动
向正极移动
B.放电时OH-向负极移动
C.负极反应为H2+C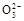 -2e-=H2O+CO2
-2e-=H2O+CO2
D.当该电池产生的水蒸气折算成标准状况下的体积为22.4 L时,转移电子4 mol
参考答案:C
本题解析:原电池中阴离子向负极移动,A错;熔融的K2CO3中没有OH-,B错;C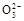 是电池内的导电微粒,该电池的总反应为2H2+O2=2H2O,用总反应式-正极反应式=负极反应式,C正确;生成1 mol水,转移电子2 mol,D错。
是电池内的导电微粒,该电池的总反应为2H2+O2=2H2O,用总反应式-正极反应式=负极反应式,C正确;生成1 mol水,转移电子2 mol,D错。
本题难度:一般
3、选择题 关于下图所示装置的叙述,错误的是

[? ]
A.锌是负极,其质量逐渐减小
B.氢离子在铜表面被还原,产生气泡
C.电流从锌片经导线流向铜片
D.电子从锌片经导线流向铜片
参考答案:C
本题解析:
本题难度:一般
4、填空题 将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如下图所示装置。试回答下列问题:

(1)若电解质溶液为稀硫酸,则Zn棒为原电池的?极,可观察到Cu棒的所产生现象是?,写出该电极反应式:?。
(2)若电解质为硫酸铜溶液,则Cu棒上发生?反应,Zn棒上发生反应的电极反应式为:?。
参考答案:(10分)(1)负极(2分)有气泡生成(或有气体放出)(2分);2H++2e-=H2↑(2分)
(2)还原 (2分)?Zn-2e-=Zn2+ (2分)
本题解析:(1)原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。锌比铜活泼,所以锌失去电子,做负极。铜是正极,溶液中的氢离子在正极得到电子,生成氢气,电极反应式是2H++2e-=H2↑,所以实验现象是有气泡生成(或有气体放出)。
(2)若电解质为硫酸铜溶液,则溶液中的铜离子在正极得到电子,发生还原反应。而锌仍然是负极,失去电子,电极反应式 是Zn-2e-=Zn2+。
点评:该题是中等难度的试题,也是高考中的常见题型,属于基础性试题的考查。试题贴近教材,基础性强,有利于激发学生的学习兴趣和学习积极性。该题的关键是明确原电池的工作原理,然后结合题意灵活运用即可。有利于培养学生的逻辑推理能力和规范的答题能力。
本题难度:一般
5、选择题 由锌—铜—稀H2SO4组成的原电池装置中,当导线中有0.2 mol电子通过时,理论上两极的变化是
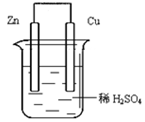
A.铜片增重6.4g
B.锌片增重6.5 g
C.铜片上析出0.1 mol O2
D.锌片溶解了6.5 g